Marion Mathelié-GuinletChercheuse à l’Institut de chimie et biologie des membranes et des nano-objets (CBMN - CNRS/Université de Bordeaux/Bordeaux INP)
Par des approches in vitro et in cellulo, et en combinant des outils biophysiques complémentaires et multi-échelles, les recherches de Marion Mathelié-Guinlet se concentrent sur la compréhension moléculaire des divers mécanismes développés par les bactéries pour exercer leur virulence. Ingénieur de l’école Centrale Lyon, elle réalise sa thèse au Laboratoire ondes et matière d’Aquitaine[1] (LOMA), qu’elle obtient en 2017, puis un postdoctorat dans le laboratoire d’Yves Dufrêne jusqu’en 2021[2] durant lesquels elle développe une expertise reconnue en microscopie à force atomique aux échelles cellulaire et moléculaire. Elle intègre, par la suite, l‘Institut de chimie et biologie des membranes et des nano-objets[3] (CBMN) grâce à deux bourses post-doctorales. Elle y est recrutée en tant que chargée de recherche CNRS en 2022, dans l’équipe « Développement en microscopie à force atomique pour la biologie », pour développer ses propres recherches, liées à certaines toxines, capables de s'auto-assembler en fibres amyloïdes, et sécrétées par Staphylococcus aureus pour favoriser divers effets délétères chez l'hôte.
PUMBA - Physical and molecular underpinnings of the multifunctionality of bacterial peptide assemblies
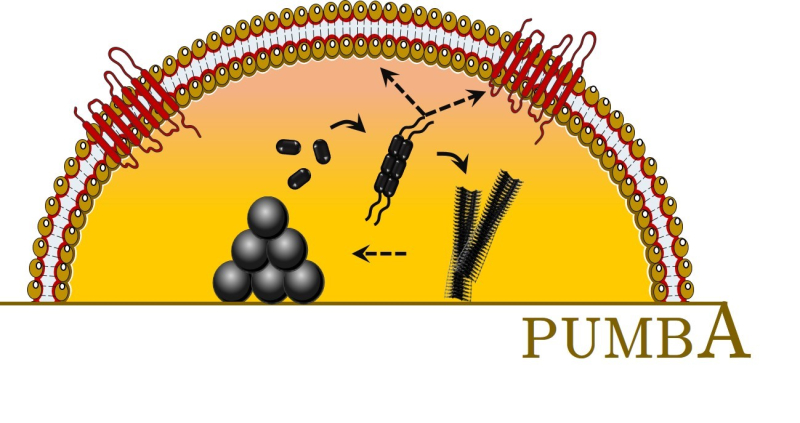
Un défi important en biophysique est de comprendre les fonctions biologiques complexes qui émergent de l’auto-assemblage de blocs de construction simples. Les phenol soluble modulins (PSMs), peptides capables de s’assembler en fibres amyloïdes et participant à la haute pathogénicité du staphylocoque doré, en sont une parfaite illustration. Les approches d’ensemble traditionnelles ont notamment permis de corréler la formation de ces fibres à la structure unique aux activités biologiques des PSMs. Au-delà de ce paradigme « une structure - une fonction », nous suggérons le rôle clé des entités intermédiaires formées lors de la fibrillation et de leurs interactions dynamiques avec les membranes biologiques rencontrées, dans l’émergence d’une fonction biologique dédiée.
Cette hypothèse, supportée par une étude à l’échelle nanométrique en temps réel du rôle de PSMa3 dans la cytotoxicité envers les cellules eucaryotes hôtes, est le fondement du ERC « PUMBA » porté par Marion Mathelié-Guinlet. Il vise à élucider les déterminants et les mécanismes moléculaires de l'auto-assemblage des PSMs et leur implication dans la multifonctionnalité des PSMs, de la formation de biofilms bactériens à l'inflammation et la toxicité chez l’hôte. Le projet cherche plus précisément à comprendre la formation de ces structures intermédiaires, complexes polydisperses et parfois transitoires, et les mécanismes d’interactions de ces diverses entités avec les lipides et protéines membranaires, constituant les cellules cibles. En identifiant, pour la première fois, les caractéristiques clés des fonctions délétères exercées par les PSMs, ce projet pourrait ouvrir la voie à la conception de nouvelles thérapies contre les infections staphylococciques, suscitant moins d'antibiorésistance.