Coup de projecteur sur les peptides thérapeutiques à base de bore
Longtemps, les composés du bore ont été écartés de l’industrie pharmaceutique à cause de leur supposée toxicité. L'approbation en 2003 du premier peptide boronique pour le traitement de cancers du sang a radicalement modifié cette perception. Face à une myriade de nouveaux peptides boroniques à l’étude, la mise au point de méthodes simples, efficaces et éco-responsables pour leur synthèse s’impose. C’est pour répondre à ce défi de la chimie médicinale que les scientifiques du laboratoire commun HitCat, associant la société Seqens et des chercheurs du CNRS, proposent une nouvelle voie d’accès à lire dans la revue Organic Letters.
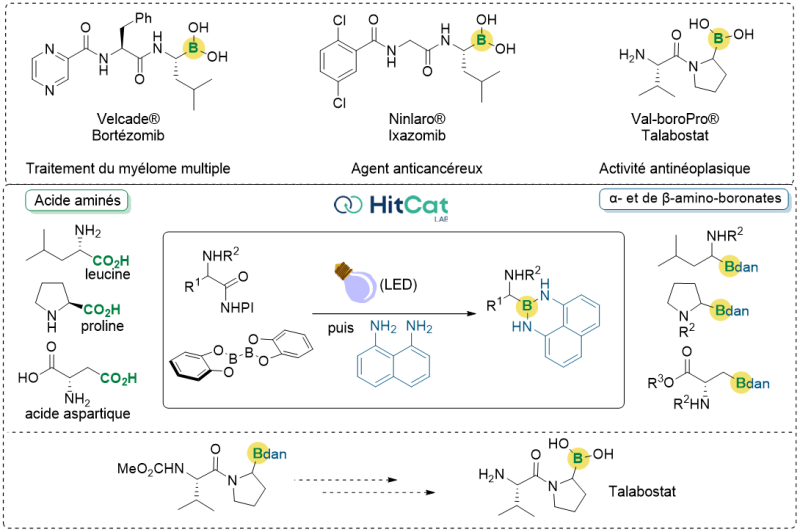
Voisin du carbone et de l’azote, le bore est un élément qui permet de créer des architectures trivalentes et offre la possibilité de liaisons très intéressantes notamment en acceptant des paires d’électrons. Il forme des composés organiques très recherchés pour la mise au point de catalyseurs et de matériaux fonctionnels en électronique, optique etc. En chimie médicinale, par contre, les composés du bore ont longtemps été boudés à cause d’une supposée toxicité. Un tournant radical a été pris en 2003 avec l’introduction sur le marché du premier peptide thérapeutique contenant du Bore, le Bortezomib. Mis au point pour traiter le myélome multiple, une forme de cancer du sang, ce premier peptide boronique a été suivi par de nombreuses autres molécules thérapeutiques dont la synthèse reste un défi. Le laboratoire commun «HitCat», partenariat entre la société SEQENS et des membres du CNRS et dirigé par les Dr. Gérard Guillamot (SEQENS) et Dr. Géraldine Masson (CNRS), dont l’objectif est de développer des méthodes catalytiques de synthèse innovantes et écoresponsables, s’est penché sur la synthèse de ces composés.
Parmi les nombreuses méthodes étudiées, la conversion d’acides carboxyliques, facilement accessibles et peu coûteux, en acides boroniques par une réaction de borylation photocatalysée est devenue une méthode de choix pour la construction de liaisons carbone-bore. Bien que très attrayante, cette transformation est peu adaptée aux acides aminés pour obtenir des acides aminoboroniques, des précurseurs très utiles des peptides boroniques d’intérêt pharmaceutique. Ceci est dû à la forte instabilité des intermédiaires réactionnels générés lors de la réaction, ce qui conduit à des rendements bien trop faibles.
Les scientifiques du laboratoire commun « HitCat » ont réussi à surmonter ces contraintes en développant un protocole simple et exempt de catalyseur. L'originalité du procédé, activé par la lumière visible, réside dans l'introduction d'une étape de protection des intermédiaires réactionnels, qui peuvent être aisément isolés avec des rendements très satisfaisants pour obtenir la molécule souhaitée. L'intégration d'une approche en flux continu a ensuite permis à l'équipe d'effectuer une montée en échelle très satisfaisante de cette synthèse, ouvrant la voie à son éventuelle industrialisation. Les chimistes ont ainsi réussi à convertir avec succès une diversité d'acides aminés en leurs homologues boronamides. De manière notable, la borylation d'un dipeptide a conduit à la synthèse d'un précurseur synthétique du Talabostat, un anti-tumoral bien connu. Cette méthode de synthèse, présentée dans la revue Organic Letters, démontre son utilité grâce à un degré élevé de complexité moléculaire combiné à une simplicité des procédés utilisés.
Rédacteur: AVR
Référence
Visible-Light-Driven Decarboxylative Borylation: Rapid Access to α- and β-Amino-boronamides
Andrea Serafino, Hugo Pierre, Franck Le Vaillant, Julien Boutet, Gérard Guillamot, Luc Neuville, and Géraldine Masson
Organic Letters 2023
https://doi.org/10.1021/acs.orglett.3c04067
