Suivre l’activité cellulaire dans les matériaux vivants imprimables en 3D
Les “Engineered living materials” (ELM), constitués de cellules vivantes logées dans un squelette de polymère biocompatible, sont des dispositifs très prometteurs comme biocapteurs ou pour la délivrance de médicaments. Mais comment s’assurer que les cellules une fois associées au biomatériau conservent leurs vitalité et fonctionnalités ? Des scientifiques du CNRS apportent de nouvelles réponses à cette question problématique dans un article paru dans Biomaterials Research.
Les « Engineered Living Materials » (ELMs) sont des dispositifs très utiles qui associent des cellules vivantes à des matériaux polymères qui imitent les conditions du vivant pour en préserver les fonctions biologiques. Ces systèmes originaux trouvent de nombreuses applications dans le domaine médical ou environnemental, de la délivrance de médicaments à la détection de polluants en passant par la régénération tissulaire ou osseuse. Les matériaux polymères utilisés pour fabriquer les ELMs doivent être biocompatibles, c’est-à-dire qu’ils doivent permettre aux cellules de rester vivantes et de préserver les fonctions pour lesquelles on souhaite les utiliser. Cependant, étudier la physiologie des cellules une fois incorporées dans un ELM reste difficile et limite leur utilisation à quelques systèmes bien maîtrisés.
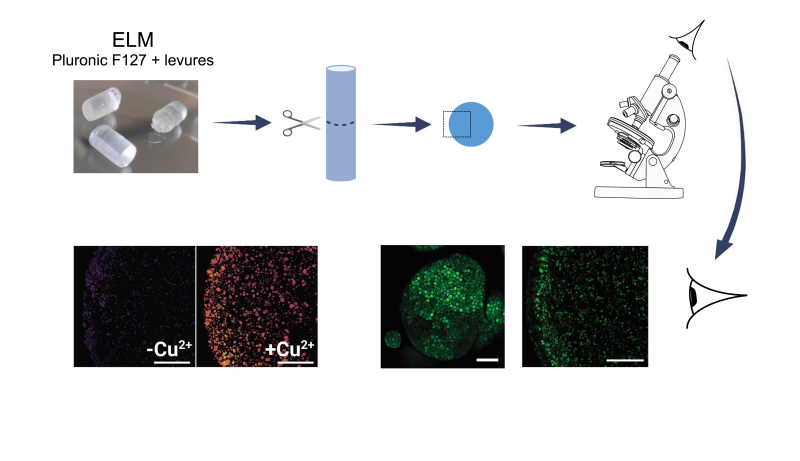
Des scientifiques du Centre de biophysique moléculaire (CNRS) ont élaboré des ELMs en associant des levures Saccharomyces cerevisiae à un hydrogel biocompatible très utilisé, le Pluronic F-127. Pour suivre l’activité cellulaire des levures une fois associées à l’hydrogel, ils les ont au préalable modifiées génétiquement en leur intégrant un gène fluorescent dont l’expression est corrélée à un paramètre physiologique comme la morphologie cellulaire ou encore la concentration en ATP (pour suivre le métabolisme) ou le pH intracellulaire (pour suivre la croissance). Les biocapteurs ainsi créés permettent d’évaluer l’état physiologique des levures directement in situ par microscopie confocale à l’échelle de la cellule unique.
Les scientifiques montrent ainsi que les cellules de levure associées à l’hydrogel F-127 ont un métabolisme actif et sont en phase de croissance exponentielle ou stationnaire comme l’indique leur pH intracellulaire. Elles forment des microcolonies ou des super-structures résultant de l’association de ces microcolonies. Leur croissance est corrélée à la présence des nutriments dont la concentration décroit dans le gel. Ils ont aussi montré que des petites molécules externes peuvent diffuser dans l’hydrogel. Ces biocapteurs (les cellules de levure génétiquement modifiées) peuvent aussi être incorporés à d’autres matériaux moins connus que l’hydrogel F-127 pour en vérifier la biocompatibilité, par exemple.
Dans un second temps, ils ont associé à l’hydrogel F-127 un autre biocapteur à base de levures récemment développé par l’équipe et qui permet de détecter et de quantifier la présence de cuivre biodisponible dans l’environnement. La bonne nouvelle est que ce biocapteur reste totalement fonctionnel tandis que l’hydrogel joue un rôle protecteur contre les contaminations et apporte les nutriments nécessaires aux cellules. Ces résultats, à retrouver dans la revue Biomaterials Research, apportent la preuve de concept que l’association de l’hydrogel F-127 à des levures génétiquement modifiées constitue un ELM prometteur pour développer des biocapteurs robustes à base de cellules entières et vivantes. La détection et la quantification de cuivre sur des prélèvements de terrain d’eau contaminée est un exemple d’application parmi les nombreuses potentialités de ces systèmes.
Référence
Confocal imaging of biomarkers at a single-cell resolution: quantifying ’living’ in 3D-printable engineered living material based on Pluronic F-127 and yeast Saccharomyces cerevisiae
Bojan Žunar, Taiga Ito, Christine Mosrin, Yoshiyuki Sugahara, Hélène Bénédetti, Régis Guégan & Béatrice Vallée, Biomaterials Research 2022.
