Nanomédecine : les lanthanides pour suivre en direct la libération de médicaments
Les liposomes sont des nanocapsules couramment utilisés en nanomédecine pour transporter et relarguer des médicaments jusqu’aux sites d’intérêt comme les tumeurs, par exemple. La molécule thérapeutique devient active seulement lors de sa libération du nanocargo, évitant d’endommager les tissus sains. A ce jour, suivre ce processus en direct in vivo reste un défi majeur. Des chimistes et des biologistes du CBM proposent une nouvelle stratégie qui utilise la luminescence proche-infrarouge des lanthanides. Une étude parue dans la revue Angewandte Chemie Int. Ed.
Les liposomes, vésicules formées par l’auto-assemblage de molécules phospholipidiques, entre autres, sont très utilisées pour transporter et libérer des agents thérapeutiques ou diagnostiques ou les deux in vivo. Le tout premier agent de nanomédicine autorisé en clinique était un liposome contenant la doxorubicine (Doxil®), une molécule anticancéreuse. Etre capable de suivre en direct la libération du médicament du liposome est crucial pour comprendre et contrôler son action. De nombreuses approches d’imagerie optique ont été proposées par le passé, qui impliquent différentes molécules thérapeutiques, nanoplateformes et stratégies de détection optique (FRET, désactivation de fluorescence (quenching), émission générée par agrégation, etc). Elles utilisent exclusivement des fluorophores organiques ou des nanoparticules inorganiques qui sont co-encapsulés dans le liposome avec le principe actif.
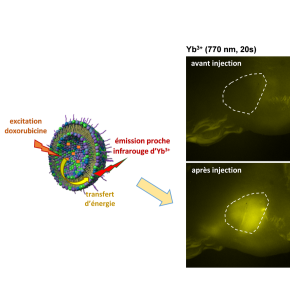
La luminescence des complexes de lanthanides est une alternative qui offrirait de nombreux avantages : une photostabilité accrue, une grande différence d’énergie qui sépare les bandes d’absorption et d’émission de la lumière, ainsi que la capacité de plusieurs lanthanides d’émettre dans le domaine proche-infrarouge, facilitant ainsi la détection dans des systèmes biologiques. Les équipes du Centre de biophysique moléculaire d’Orléans ont mis au point un système innovant qui intègre un complexe d’ytterbium à l’intérieur d’un liposome qui contient aussi de la doxorubicine. Dans cet assemblage, la luminescence proche-infrarouge du complexe de lanthanide est observable uniquement en présence du médicament dans le liposome. Le signal de luminescence proche-infrarouge devient ainsi un outil pour le suivi direct et en temps réel de l’intégrité du liposome et, ainsi, de la libération du médicament. Les chercheurs ont pu démontrer que cette luminescence proche-infrarouge provenant du lanthanide est facilement détectable in vivo avec un appareil d’imagerie optique commercial. Injectée dans une souris porteuse d’une tumeur mammaire, le liposome contenant un complexe amphiphile d’ytterbium et la doxorubicine génère un signal optique proche-infrarouge suffisamment intense et persistant dans la tumeur en dépit des rendements quantiques relativement faibles. Cette première preuve de concept est à retrouver publiée dans la revue Angewandte Chemie Int. Ed.
Rédacteur: AVR
Référence
Doxorubicin-sensitized Luminescence of NIR-emitting Ytterbium Liposomes: Towards Direct Monitoring of Drug Release, Sara Lacerda, Anthony Delalande, Svetlana V. Eliseeva, Agnès Pallier, Célia S. Bonnet, Frédéric Szeremeta, Sandra Même, Chantal Pichon, Stéphane Petoud, Eva Toth, Angewandte Chemie Int. Ed. 13 août 2021