Une synthèse bioinspirée et efficace d’une substance naturelle complexe, la (+)-mayténone
Des chimistes de l’ISM (Université de Bordeaux/CNRS/Bordeaux INP) et du laboratoire COBRA (Université de Rouen Normandie/CNRS/INSA Rouen) ont réalisé la synthèse bioinspirée de la (+)-mayténone, une substance naturelle isolée pour la première fois il y a 60 ans de l’écorce des racines de l’arbre Maytenus dispermus et jamais synthétisée jusqu’ici. Ces travaux, en couverture de la revue Angewandte Chemie, permettent d’élucider les mécanismes réactionnels en faveur d’une chimie plus verte qui conduisent à cette molécule complexe, tant en laboratoire que dans la plante.
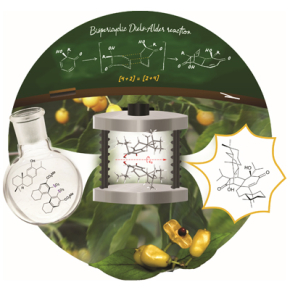
La synthèse chimique de molécules naturelles complexes, à l’origine du développement de nombreux médicaments, nécessite trop souvent de longs et coûteux efforts en laboratoire. Le développement de nouvelles méthodes de synthèse organique bioinspirées est un des jalons vers une préparation plus efficiente de ces molécules. En effet, la nature utilise des enzymes et autres protéines qui assistent et gouvernent ces biosynthèses pour obtenir exactement l’architecture moléculaire désirée. Des chimistes de l’Institut des sciences moléculaires (Université de Bordeaux/CNRS/Bordeaux INP) et du laboratoire Chimie organique, bioorganique : réactivité et analyse (Université de Rouen Normandie /CNRS/INSA Rouen) ont récemment trouvé d’autres moyens pour atteindre le même degré de contrôle en laboratoire. C’est ce qu’ils illustrent dans le cas de la (+)-mayténone, un bisditerpénoïde isolé pour la première fois il y a 60 ans de l’écorce des racines de l’arbre Maytenus dispermus (Celastraceae).
Grâce à l’utilisation de réactifs chiraux originaux à base d’iode hypervalent, une alternative verte aux réactifs à base de métaux souvent toxiques, les chercheurs ont réalisé cette synthèse chimique et bioinspirée de la (+)-mayténone en seulement 6 étapes. Ils ont ainsi mis au point une réaction de Diels-Alder* pour combiner (cyclodimériser) deux ortho-quinols* avec un contrôle parfait de la structure moléculaire obtenue et ce sans avoir recours à une enzyme. Les scientifiques ont en effet confirmé à l’aide de calculs de chimie quantique que ce contrôle provient de la molécule elle-même. L’astuce supplémentaire a consisté à effectuer ces réactions sous haute pression. Ces conditions expérimentales permettent de créer un micro-environnement qui force le rapprochement physique et la combinaison bispéricyclique des deux ortho-quinols pour atteindre la molécule finale. Ce résultat, en couverture de et sélectionné comme very important paper par la revue Angewandte Chemie, apporte les éléments clés de la biosynthèse de cette classe de substances naturelles, de leur synthèse chimique et de l’accès à d’autres cyclodimères naturels ou non d’intérêt thérapeutique.
*Découverte en 1928, la cycloaddition de Diels et Alder, qui leur valut le prix Nobel de chimie en 1950, est une réaction clé pour la synthèse organique de molécules complexes. Il s’agit d’une réaction péricyclique formant deux liaisons à partir d'un diène conjugué et d’un diénophile.
*Ortho-quinol est le nom usuel utilisé pour les entités organiques de type 6-alkyl-6-hydroxycyclohexa-2,4-dienone.
Rédacteur : AVR

Référence
Bispericyclic Diels–Alder Dimerization of ortho-Quinols in Natural Product (Bio)Synthesis – Bioinspired Chemical 6-Step Synthesis of (+)-Maytenone Philippe A. Peixoto, Mourad El Assal, Isabelle Chataigner, Frédéric Castet, Anaëlle Cornu, Romain Coffinier, Cyril Bosset, Denis Deffieux, Laurent Pouységu and Stéphane Quideau, Angew. Chem. Int. Ed. 14 avril 2021.