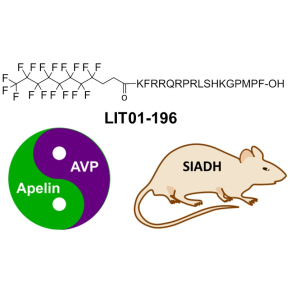
Une stratégie innovante pour traiter l’hyponatrémie
L’hyponatrémie est une baisse pathologique du taux de sodium dans le sang, pouvant conduire au coma, voire au décès. Elle pourrait être traitée par l’apeline, mais cette molécule, comme la plupart des peptides, est dégradée en seulement quelques minutes par l’organisme. Des chercheurs du LIT (CNRS/Université de Strasbourg) et du CIRB (CNRS/Collège de France/INSERM) ont mis au point une méthode qui améliore considérablement la stabilité de l’apeline et a permis de développer une nouvelle approche thérapeutique pour le traitement de l’hyponatrémie. Ces travaux, publiés dans Nature Communications, pourraient aussi s’appliquer à d’autres peptides à visée thérapeutique.
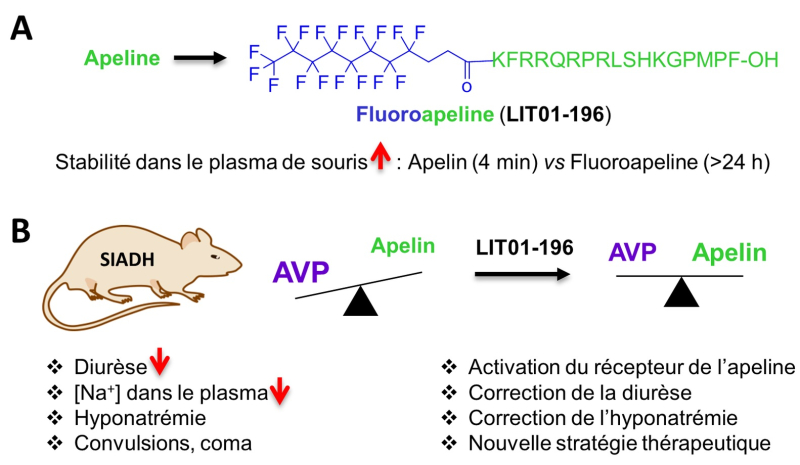
Les peptides sont des polymères d’acides aminés dont les innombrables fonctions biologiques en font une source potentielle importante pour le développement de nouveaux médicaments. Mais sur les 7000 peptides identifiés à ce jour, seuls soixante sont actuellement sur le marché car ces molécules, naturelles mais très instables, sont rapidement dégradées et éliminées par l’organisme. Parmi les maladies qu’ils pourraient aider à traiter, l’hyponatrémie est une chute de la concentration de sodium dans le sang, un état que l’on retrouve chez un tiers des personnes hospitalisées et qui peut aggraver leurs problèmes jusqu’à causer leur décès. L’hyponatrémie peut être la conséquence d’une production excessive d’une hormone antidiurétique, l’arginine vasopressine (AVP), qui, en empêchant l’élimination de l’eau au niveau des reins, entraîne une augmentation du volume sanguin et donc la diminution de la concentration en sodium. Le tolvaptan est l’un des principaux médicaments disponibles pour corriger l’hyponatrémie, mais il peut malheureusement présenter des effets secondaires importants. L’apeline pourrait également réguler l’hyponatrémie par un mécanisme d’action différent, ce peptide est cependant dégradé en moins de cinq minutes par l’organisme. Pour évaluer son potentiel thérapeutique, des chercheurs du Laboratoire d’innovation thérapeutique (LIT, CNRS/Université de Strasbourg) et du Centre interdisciplinaire de recherche en biologie (CIRB, CNRS/Collège de France/INSERM) ont développé une méthode qui modifie l’apeline, améliorant sa stabilité dans le plasma sanguin de cinq minutes à vingt-quatre heures, et ce sans altérer ses propriétés pharmacologiques.
Leur approche, brevetée sous le nom FluoroPEP, adjoint une chaîne d’atomes de fluor et de carbone à l’apeline, la transformant en une molécule appelée LIT01-196. Celle-ci résiste alors à l’action des enzymes qui dégradent les peptides, mais continue à activer le récepteur de l’apeline. LIT01-196 a été testée sur un modèle de rats souffrant du syndrome de sécrétion inappropriée d’hormone antidiurétique (SIADH). La molécule, en agissant sur le récepteur de l’apeline, a bloqué l’effet antidiurétique de l’AVP, corrigeant progressivement l’hyponatrémie causée par le SIADH. Cette découverte ouvre de nouvelles perspectives thérapeutiques pour le traitement de l’hyponatrémie et, de façon plus générale, dans le développement de peptides médicaments.
Référence
A metabolically stable apelin-17 analog decreases AVP-induced antidiuresis and improves hyponatremia
Adrien Flahault, Pierre-Emmanuel Girault-Sotias, Mathilde Keck, Rodrigo Alvear-Perez, Nadia De Mota, Lucie Estéoulle, Sridévi M Ramanoudjame, Xavier Iturrioz, Dominique Bonnet et Catherine Llorens-Cortes Nature Communications, volume 12, Article number: 305 (2021)