Confiner l’eau pour de meilleurs rendements pour l’hydrogène vert et les électrosynthèses
Certaines réactions sont boostées par l’électricité via un électrolyte qui assure la conduction des ions et des réactifs. Mais dans le cas d’électrolytes aqueux, l’eau ne se contente pas d’être un simple solvant : elle va aussi réagir et former de l’hydrogène. Afin de mieux comprendre ce phénomène, des chercheurs des laboratoires CSE (CNRS/Sorbonne Université/Collège de France), PHENIX (CNRS/Sorbonne Université) et CEMHTI (CNRS) ont développé une méthode pour confiner les molécules d’eau, et ainsi séparer leur comportement de réactif et de solvant. Ces travaux, publiés dans la revue Nature Catalysis, illustrent le rôle complexe du milieu réactionnel dans la cinétique de production d’hydrogène vert. Ils pourraient aussi conduire à une meilleure valorisation du dioxyde de carbone et production d’ammoniac.
Certaines réactions chimiques, comme la production d’hydrogène, nécessitent un apport d’énergie conséquent et consomment donc de l’énergie souvent fossile. Afin de limiter les émissions de CO2, ces énergies fossiles peuvent être substituées par de l’électricité apportée via des électrodes : on parle alors d’électrocatalyse. Cette technique permet en particulier la réduction de différentes molécules, comme l’eau (H2O) pour en tirer du dihydrogène (H2). Le dioxyde de carbone (CO2) peut lui aussi être cassé et recombiné en hydrocarbures plus complexes, tandis que la réduction du diazote (N2) permet d’obtenir de l’ammoniac (NH3) pour des engrais et des espèces organiques à fortes valeurs ajoutées. Différentes espèces, comme le CO2 et le N2, doivent être dissoutes dans de l’eau qui leur sert de solvant. Cependant, l’eau réagit elle aussi à cause de l’électricité. Le détail des réactions en jeu et de leur cinétique est alors difficile à suivre, et donc à optimiser. Des chercheurs des laboratoires Chimie du solide et de l’énergie (CSE, CNRS/Sorbonne Université/Collège de France), Physico-chimie des électrolytes et nanosystèmes interfaciaux (PHENIX, CNRS/Sorbonne Université) et Conditions extrêmes et matériaux : haute température et irradiation (CEMHTI, CNRS) proposent une nouvelle approche méthodologique pour étudier en profondeur ces mécanismes, en confinant l’eau.
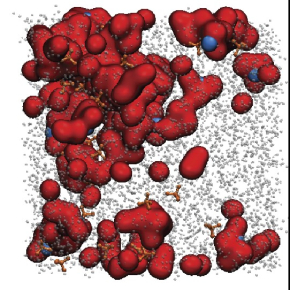
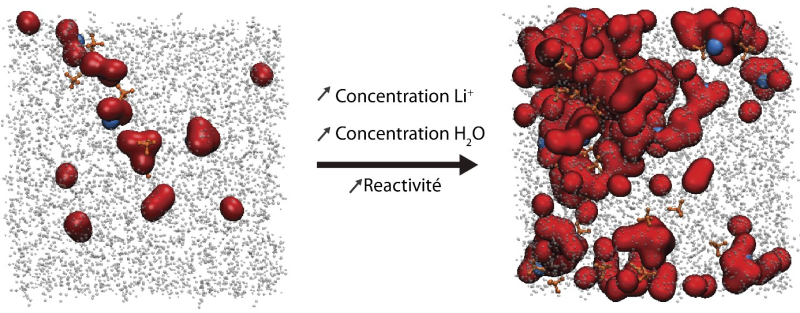
Les chimistes ont ici placé l’eau dans un solvant organique et inerte, dans lequel les molécules d’eau ont tendance à se confiner en groupes distincts, plutôt que de se répartir aléatoirement. L’équipe a contrôlé et amplifié le phénomène en jouant sur les teneurs en eau, en sel et en solvant organique, obtenant ainsi des nanoréacteurs d’eau : des minuscules agrégats d’eau et de sel. L’action de l’eau en tant que réactif y est alors bien distincte de son action en tant que solvant, ce qui permet d’étudier finement les différences entre ces deux comportements. Les chercheurs, tous membres du Réseau sur le stockage électrochimique de l’énergie (RS2E), espèrent qu’une meilleure maîtrise des nanodomaines aiderait à fixer le potentiel électrique auquel l’eau réagit, afin de contrôler à quel point elle intervient ou non dans la réduction d’espèces dissoutes en elle. Cela permettrait alors d’améliorer les rendements pour la production d’hydrogène vert, mais aussi de la réduction du CO2 et du N2, et donc de produire les mêmes quantités avec moins d’énergie.
Référence
Nicolas Dubouis, Alessandra Serva, Roxanne Berthin, Guillaume Jeanmairet, Benjamin Porcheron, Élodie Salager, Mathieu Salanne & Alexis Grimaud. Tuning water reduction through controlled nanoconfinement within an organic liquid matrix. Nature Catalysis, 27/07/20.