L’exceptionnelle puissance des inhibiteurs enzymatiques multivalents
Optimiser l’action des inhibiteurs d’enzymes est une voie particulièrement prometteuse pour concevoir de nouveaux médicaments. Des chercheurs strasbourgeois du Laboratoire d’innovation moléculaire et application (LIMA - Unistra/UHA/CNRS) et de l’Institut de génétique et de biologie moléculaire et cellulaire (IGBMC - CNRS/Inserm/Unistra) ont mis au point un composé particulier, formé par l’association de 36 copies d’un même inhibiteur. Ce composé dit multivalent s’avère capable de bloquer non pas 36 fois mais 200 000 fois plus fortement l’activité de l’enzyme ciblée. Publiés dans la revue Angew. Chemie Int. Ed., ces travaux ont permis de révéler le mode d’action de ce « super inhibiteur ».
En catalysant des réactions chimiques essentielles au fonctionnement des organismes vivants, les enzymes jouent un rôle fondamental. C’est le cas des glycosidases qui décomposent des sucres complexes en sucres simples et interviennent ainsi dans de nombreux mécanismes, comme la régulation de la glycémie chez l’Homme. Concrètement, chaque famille d’enzymes agit grâce à un site spécifique, le site actif, où se produit la réaction : une molécule appelée substrat vient se fixer sur le site actif où elle est transformée en une nouvelle molécule. Développer des inhibiteurs d’enzymes ou inhibiteurs enzymatiques, soit des molécules capables de prendre la place du substrat dans le site actif et de bloquer la réaction, est aujourd’hui une piste très utilisée pour élaborer les médicaments (exemple du Tamiflu® qui bloque le mécanisme d’infection du virus de la grippe).
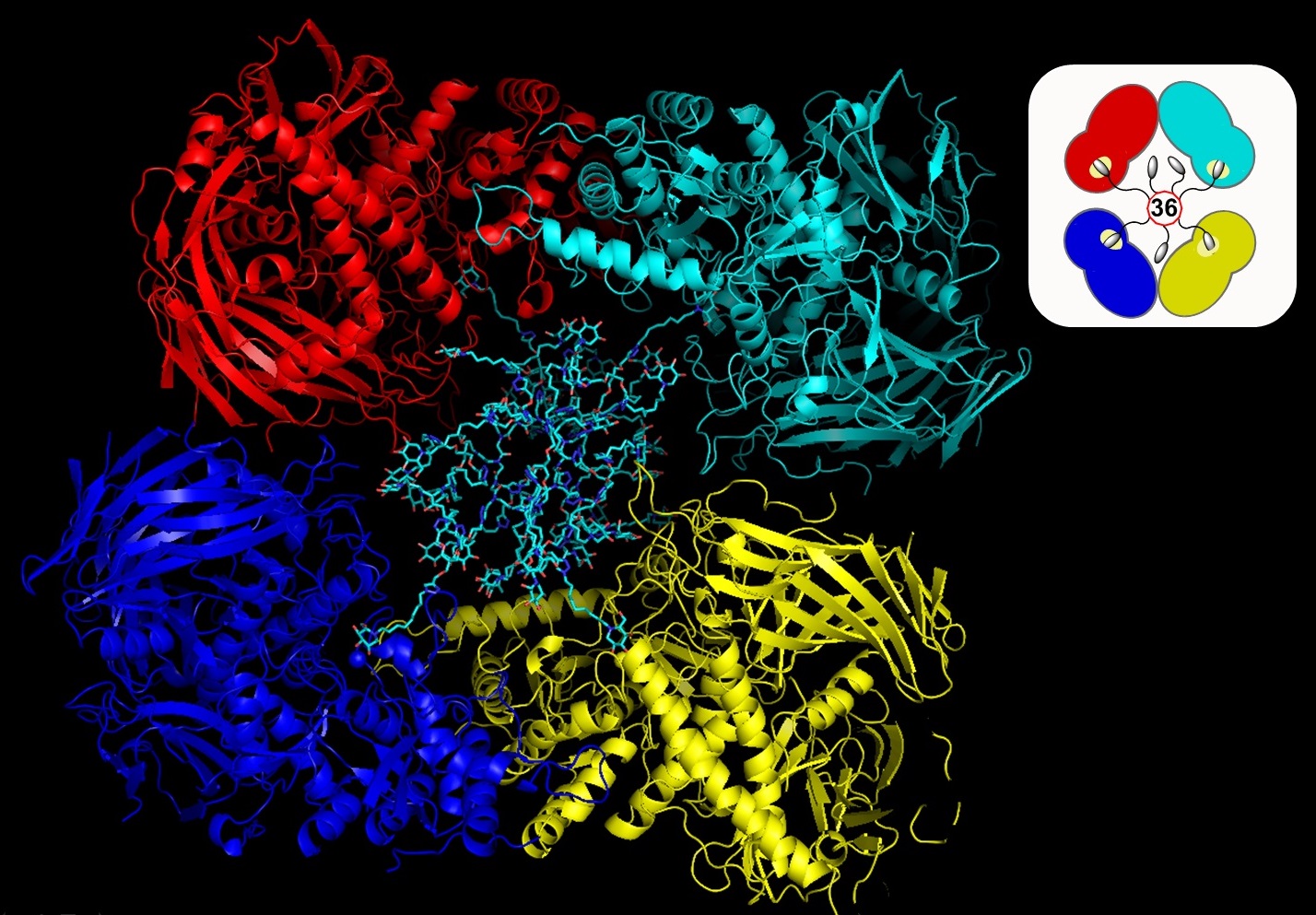
L’un des enjeux dans le domaine des inhibiteurs enzymatiques est d’augmenter leur pouvoir d’inhibition. C’est un record en la matière que des chercheurs strasbourgeois du Laboratoire d’innovation moléculaire et application (Unistra/UHA/CNRS) et de l’Institut de génétique et de biologie moléculaire et cellulaire (CNRS/Inserm/Unistra) ont obtenu en mettant au point un inhibiteur multivalent. En attachant, sur une molécule support, 36 exemplaires d’un inhibiteur connu d’une glycosidase modèle (la Jack bean α-Mannosidase, présente chez certains végétaux), ils ont en effet constaté que le pouvoir d’inhibition obtenu sur l’enzyme n’était pas 36 fois plus fort que celui d’un seul exemplaire d’inhibiteur, mais 200 000 fois plus ! Restait à comprendre d’où provient cet effet démultiplicateur... À partir de l’analyse structurale par rayons X de haute énergie, ils ont révélé la structure tridimensionnelle de l’enzyme et du complexe qu’elle forme avec l’inhibiteur à 36 copies : un complexe en forme de sandwich composé de deux enzymes (chacune dotée de deux sites actifs) entre lesquelles est logé l’inhibiteur à 36 copies et auxquelles il est fixé par les quatre sites actifs. Une telle organisation confère une structure très stable au complexe, concentre les inhibiteurs autour des sites actifs et renforce ainsi l’inhibition.
Disposant désormais d’un portrait-robot d’une glycosidase sensible à l’effet multivalent, les chercheurs envisagent de tester ce « super inhibiteur » sur des enzymes humaines de structure comparable à la glycosidase utilisée dans l’étude et dotées d’un intérêt thérapeutique. Si le même effet est retrouvé, de nouveaux médicaments particulièrement efficaces pourraient voir le jour.
©Alberto Podjarny
Référence
E. Howard, A. Cousido-Siah, M. L. Lepage, J. P. Schneider, A. Bodlenner, A. Mitschler, A. Meli, I. Izzo, A. Alvarez, A. Podjarny, P. Compain
Structural Basis of Outstanding Multivalent Effects in Jack bean a-Mannosidase Inhibition
Angew. Chem. Int. Ed – Mai 2018
DOI : 10.1002/anie.201801202