Vers un recyclage efficace du CO2
Le recyclage du monoxyde et du dioxyde de carbone (CO et CO2) en hydrocarbures est possible, mais certaines étapes de ces procédés coûtent encore plus d’énergie qu’elles n’en sauvent. Des chercheurs du CNRS et des universités Paris-Sud et Rennes 1 se sont inspirés d’une enzyme naturelle pour améliorer les catalyseurs utilisés dans la réduction du CO2 en CO. Grâce à ces travaux, publiés dans la revue Angewandte Chemie, cette phase demande moins d’énergie et n’a pas plus besoin de consommer d’acides.
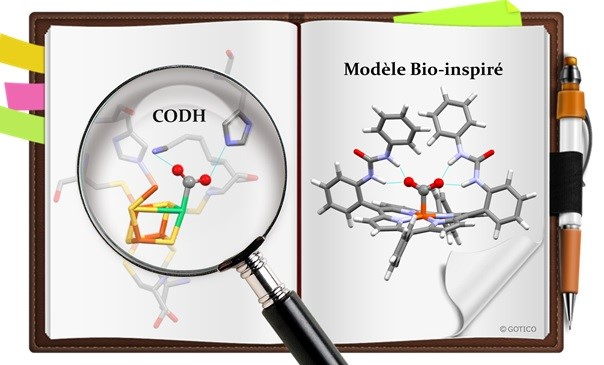
Parmi les pistes pour combattre le réchauffement climatique, les procédés de Fischer-Tropsch recyclent le monoxyde de carbone (CO) en hydrocarbures. Mais pour que cela fonctionne à partir de dioxyde de carbone (CO2), ce dernier doit être réduit en CO. Une étape qui réclame deux électrons et deux protons, apportés sous forme d’énergie pour les premiers et par des acides pour les seconds : le système n’est alors pas rentable des points de vue économiques et écologiques. En s’inspirant d’une enzyme présente dans certaines bactéries, des chercheurs de l’Institut de Chimie Moléculaire et des Matériaux d’Orsay (ICMMO, CNRS/Université Paris-Sud), Institut de Biologie Intégrative de la Cellule (I2BC, CNRS/Université Paris-Sud/CEA) et de l’Institut des Sciences Chimiques de Rennes (ISCR, CNRS/INSA Rennes/ENSC Rennes/Université Rennes 1) sont parvenus à une réduction du CO2 à la fois moins énergivore et qui ne demande plus l’ajout d’acide.
Les scientifiques se sont ainsi concentrés sur l’enzyme monoxyde de carbone déshydrogénase, dont les atomes de fer et de nickel forment un centre très efficace pour réduire réversiblement le CO2 en CO. Son succès passe par deux acides aminés qui aident à immobiliser le CO2. Les chercheurs ont donc employé une stratégie similaire en introduisant de petites molécules azotées, dans un catalyseur proche des composants qui permettent aux globules rouges de transporter le dioxygène dans le sang : les porphyrines de fer. Le CO2 ainsi capturé est réduit en CO a un potentiel plus bas de 300 mV, soit environ 40 % de gain, ce qui représente une économie d’énergie significative. L’enzyme piège également des molécules d’eau qui fournissent les protons nécessaires à la réaction, ce qui fait qu’il n’y a plus besoin d’ajouter des acides. Ces travaux doivent encore être transposés à échelle industrielle, mais ils apportent de nouvelles perspectives pour le développement de catalyseurs moléculaires pour la réduction du carbone dans l’atmosphère.
Référence
Philipp Gotico, Bernard Boitrel, Regis Guillot, Marie Sircoglou, Annamaria Quaranta, Zakaria Halime, Winfried Leibl et Ally Aukauloo
Second sphere biomimetic multipoint hydrogen bonding patterns to boost CO2 reduction of iron porphyrins
Angewandte Chemie International Edition - Mars 2019