Vers des nouveaux marqueurs d’imagerie pour la détection in vivo des pathologies comme Alzheimer ou le diabète.
L’accumulation d’agrégats de certains peptides non solubles dans les tissus est caractéristique de plusieurs pathologies, comme les maladies d’Alzheimer et de Parkinson, ou encore le diabète. La détection de ces dépôts amyloïdes par imagerie in vivo serait très utile pour un diagnostic précoce et une meilleure compréhension des mécanismes moléculaires de ces maladies. Des chercheurs du CBM et du LCC, en collaboration avec des scientifiques portugais et hongrois, ont franchi une étape importante dans la conception d’agents d’imagerie qui reconnaissent spécifiquement ces dépôts amyloïdes. Ces travaux font la couverture de Chemistry A European Journal.
Les plaques amyloïdes sont des amas qui se forment dans nos tissus par agrégations de protéines altérées ou peptides insolubles qui ont perdu leur fonction biologique. Appelée amyloïdose, la formation de tels dépôts solides entre les neurones est le biomarqueur de la maladie d’Alzheimer et de bien d’autres maladies neurodégénératives, tandis que dans le pancréas elle est à l’origine du diabète. Nombre de chercheurs travaillent sur la mise au point de marqueurs spécifiques qui permettraient de mettre en évidence ces agrégats in vivo par une technique d’imagerie non invasive comme l’imagerie par résonnance magnétique (IRM). Des complexes métalliques ont été ainsi mis au point, qui comportent une unité ciblant spécifiquement les peptides et agrégats amyloïdes. Par exemple, les chélates de gadolinium sont des sondes IRM potentielles, alors que les complexes de certains métaux radioactifs (64Cu, 99mTc, etc) peuvent être exploités en imagerie nucléaire. En outre, d’autres complexes métalliques ont été proposés pour le développement de stratégies thérapeutiques, car ils sont capables de ralentir la formation des plaques amyloïdes.
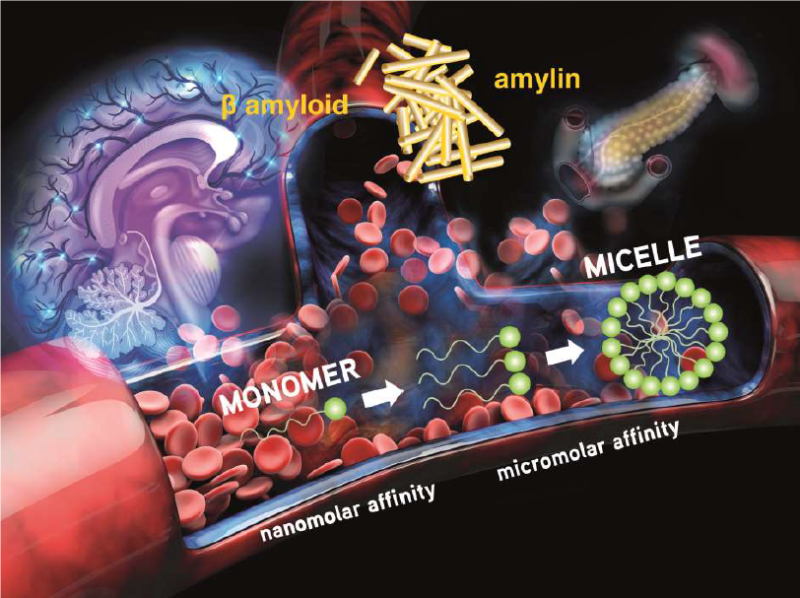
Toutes ces molécules sont amphiphiles car elles sont constituées d’une partie hydrophile (la partie qui contient le métal) et d’une partie hydrophobe (celle qui est capable de reconnaitre le peptide). A l’instar du savon, ces molécules forment différents types de micelles dans l’eau et dans un environnement biologique. Les équipes du Centre de biophysique moléculaire d’Orléans et du Laboratoire de chimie de coordination de Toulouse, en collaboration avec des chercheurs portugais et hongrois, ont découvert que cette propriété de micellisation a des conséquences drastiques sur leur efficacité, à savoir, leur capacité à reconnaître les peptides amyloïdes ciblés, mais également leur biodistribution in vivo. En jouant sur la longueur de la partie hydrophobe, les chercheurs ont synthétisé un nouveau complexe de gadolinium qui, à très faible concentration, possède une affinité exceptionnelle pour les agrégats d’amyloïdes Ab et d’amyline, respectivement biomarqueurs de la maladie d’Alzheimer et du diabète. Néanmoins, une interaction aussi forte entre le complexe et les amyloïdes n’est observée que lorsque les molécules sont sous forme « individuelle ». Dès que la concentration de ce marqueur dans la solution injectée augmente, des micelles se forment et l’affinité du marqueur pour les agrégats ciblés chute de trois ordres de grandeur. Ces résultats, sans doute transposables à toute sorte de molécules amphiphiles en milieux biologique, doivent dorénavant être pris en compte dans la conception de molécules pour l’imagerie et la thérapie des amyloïdoses.
Réacteur: AVR
Référence
Concentration‐dependent interactions of amphiphilic PiB‐ derivative metal complexes with amyloid peptides Aβ and amylin Saida Majdoub , Zoltán Garda , Alexandre C. Oliveira, Inga Relich , Agnès Pallier , Sara Lacerda , Christelle Hureau , Carlos F.G.C. Geraldes , Jean-François Morfin et Éva Tóth, Chemistry A European Journal, 7 octobre 2020.
