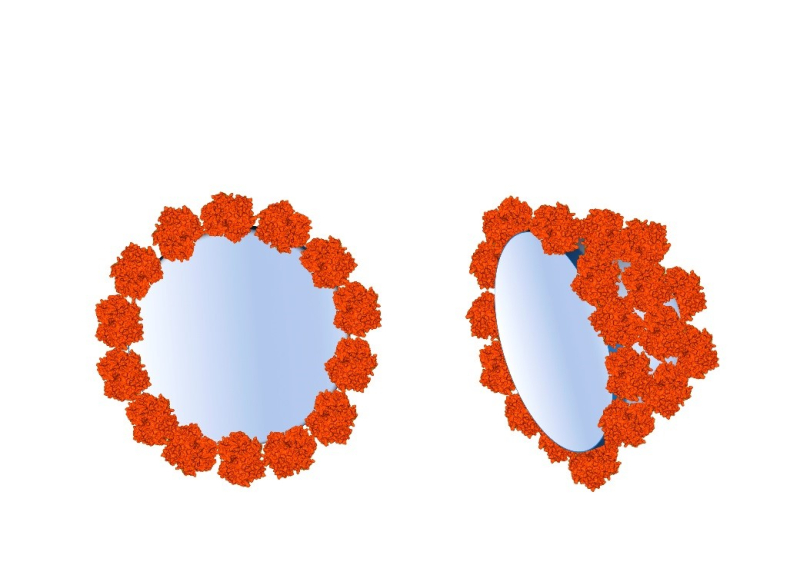
Une couronne d’hémoglobine éclaire les réactions des nanoparticules dans leur milieu biologique
En milieu biologique, les nanoobjets (nanoparticules, nanomatériaux, etc.) s’entourent d’une couronne de protéines, dont la fonction est encore mal connue. Des chercheurs du laboratoire Nanosciences et innovation pour les matériaux, la biomédecine et l'énergie (NIMBE, CNRS/CEA), de l’Institut de biologie intégrative de la cellule (I2BC, UPSud/CNRS/CEA) et du Laboratoire Léon Brillouin (CNRS/CEA) ont détaillé la structure d’une couronne de moléules d’hémoglobine, explicitant son rôle dans l’activité biologique de la nanoparticule sur laquelle elles sont adsorbées. Des résultats, à retrouver dans la revue Langmuir, qui répondent à des enjeux en nanomédecine et toxicologie.
Les développements futurs en nanomédecine et nanotoxicologie dépendent d'une meilleure compréhension du comportement des nanoobjets, particules naturelles ou matériaux, dans les milieux biologiques (cellules, fluides intra ou extracellulaires). Au contact de tels milieux, les nanoobjets se recouvrent spontanément d'une couronne de protéines appelée « corona », acquérant une « identité biologique » spécifique qui peut conditionner leur biodistribution et leur éventuelle toxicité. Une équipe interdisciplinaire du laboratoire Nanosciences et innovation pour les matériaux, la biomédecine et l'énergie (NIMBE, CNRS/CEA) et de l’Institut de biologie intégrative de la cellule (I2BC, UPSud/CNRS/CEA) s’est intéressée à la structure de la couronne assemblée quand deux protéines modèles, la myoglobine et l'hémoglobine, sont adsorbées sur une nanoparticule.
Avec l’aide de chercheurs du Laboratoire Léon Brillouin (CNRS/CEA) et en utilisant la technique de diffusion des neutrons aux petits angles, l’équipe a observé une large augmentation de la capacité de l’hémoglobine à fixer l'oxygène, sans modification de forme, lorsque la couronne est assemblée. Cette même analyse a également permis de mesurer l’épaisseur de la corona, montrant que les molécules d’hémoglobine forment une monocouche organisée à la surface de la nanoparticule: l’objet ainsi formé est donc un véritable nanoassemblage contrôlé.
L’adsorption de protéines à leur surface semble également provoquer une agrégation de nanoparticules. La détection de ce phénomène jusque-là négligé ouvre la voie à une meilleure compréhension de l’impact de la corona sur l’activité biologique des nanoparticules.
L. Marichal, G. Giraudon--Colas, F. Cousin, A. Thill, J. Labarre, Y. Boulard, J.-C. Aude, S. Pin, J.P. Renault
Protein-nanoparticle interactions: what are the protein-corona thickness and organization ?
Langmuir – Juillet 2019