Une bactérie de notre intestin livre un nouvel antibiotique
Alors que le monde s’inquiète de la résistance croissante des bactéries aux antibiotiques, certaines solutions se trouvent en nous-mêmes. Des chercheurs, principalement basés à Grenoble et à Marseille, ont ainsi découvert qu’une bactérie présente dans notre intestin produisait un antibiotique particulièrement intéressant : la ruminococcine C1. Elle est en effet efficace contre des souches bactériennes résistantes sans leur faire développer de nouvelles défenses, ne se dénature pas dans des conditions physiologiques et est compatible avec un développement industriel. Publiés dans la revue PNAS, ces travaux ouvrent la voie à l’exploration de toute une famille d’antibiotiques.
Dans le monde de l’infiniment petit, les microorganismes s’affrontent et se défendent en produisant et relâchant différentes molécules dans leur environnement proche. Ainsi, certaines bactéries émettent des composés naturels aux propriétés antibiotiques, très intéressants pour contrer les microbes pathogènes qui développent des résistances aux médicaments. Une vaste équipe de chercheurs a donc décidé d’étudier les microorganismes présents dans notre système digestif, mais inoffensifs pour nous, avec l’idée que leurs mécanismes de défense sont déjà adaptés à notre corps et n’ont pas d’effets secondaires. La bactérie Ruminococcus gnavus, produit une famille de cinq molécules antimicrobiennes, dont la ruminococcine C1 (RumC1). Les scientifiques ont synthétisé ce peptide, c’est-à-dire un polymère constitué d’acides aminés, en laboratoire et découvert qu’il est un excellent candidat pour de nouveaux antibiotiques.
In vitro, RumC1 s’est montré efficace, même à très faibles doses, contre divers pathogènes liés à des infections nosocomiales et de l’intestin. Parmi eux, Enterococcus faecalis et Clostridium difficile, classés par l’OMS dans la liste des bactéries résistantes aux antibiotiques les plus préoccupantes, où l’on retrouve par exemple le staphylocoque doré. Le mode d’action de RumC1, pas encore compris, n’a pas entraîné de développement de résistance chez les bactéries qu’elle cible. Le peptide est de plus actif dans des conditions mimant celles de l’intestin et n’est pas toxique pour les tissus intestinaux. RumC1 se démarque également par sa structure en double épingle, une forme jusqu’alors inconnue chez cette famille de peptides. Sa structure très compacte permet au peptide de résister à plusieurs traitements physico-chimiques, comme les changements de pH ou encore à l’action de différentes enzymes. Tout cela signifie que RumC1 peut être administré sous forme de médicament, et qu’il peut être fabriqué et manipulé en grandes quantités par des procédés industriels. Les chercheurs tentent à présent de mieux comprendre l’origine de l’efficacité antibiotique de RumC1 et vont également explorer les autres molécules produites par Ruminococcus gnavus.
Ces travaux ont rassemblé une vaste équipe de chercheurs, issus de l’Institut des Sciences Moléculaires de Marseille (ISM2, CNRS/Aix-Marseille Université/Centrale Marseille), du Laboratoire de Chimie et Biologie des Métaux (LCBM, CNRS/CEA/Université Grenoble Alpes), de l’Institut de Microbiologie de la Méditerranée (IMM, CNRS/Aix-Marseille Université), du Laboratoire d’Ingénierie des Systèmes Macromoléculaires (LISM, CNRS/Aix-Marseille Université), de l’Université Technique de Kaiserslautern (Allemagne), du Centre National de Référence de la Résistance aux Antibiotiques (CHU de Besançon), du Laboratoire Chrono-Environnement (CNRS/Université de Franche-Comté), de l’Hôpital Laveran (Marseille), de l’Institut de Neuro-Physio-Pathologie (Faculté de Médecine, Aix-Marseille Université) et du Laboratoire de Microbiologie et Génétique Moléculaires (LMGM, CNRS/Université Paul Sabatier Toulouse).
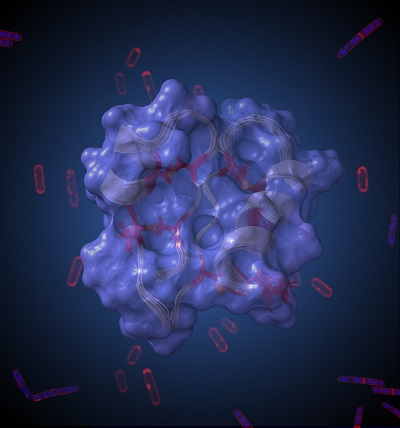
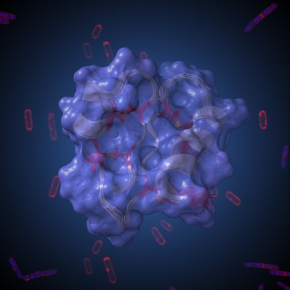
Légende de l'illustration : représentation artistique de la structure 3D du peptide antimicrobien RumC1 résolue par résonance magnétique nucléaire. Cette structure compacte en double épingle confère à RumC1 d’importantes propriétés cliniques, dont une remarquable activité bactéricide contre des pathogènes multirésistants aux antibiotiques courants.
Référence
Clarisse Roblin, Steve Chiumento, Olivier Bornet, Matthieu Nouailler, Christina S. Müller, Katy Jeannot, Christian Basset, Sylvie Kieffer-Jaquinod, Yohann Couté, Stéphane Torelli, Laurent Le Pape, Volker Schünemann, Hamza Olleik, Bruno De La Villeon, Philippe Sockeel, Eric Di Pasquale, Cendrine Nicoletti, Nicolas Vidal, Leonora Poljak, Olga Iranzo, Thierry Giardina, Michel Fons, Estelle Devillard, Patrice Polard, Marc Maresca, Josette Perrier, Mohamed Atta, Françoise Guerlesquin, Mickael Lafond, Victor Duarte. The unusual structure of Ruminococcin C1 antimicrobial peptide confers clinical properties. Proc. Natl. Acad. Sci. U S A. 2020.