Une avancée importante dans la synthèse asymétrique de composés chiraux
Le (+)-myrioneurinol est une molécule naturelle que l’on cherche à produire de manière synthétique à cause de ses propriétés antipaludiques. Elle présente deux formes appelées énantiomères, de même formule chimique et images l’un de l’autre dans un miroir, dont les activités biologiques sont très différentes. En développant une approche conceptuellement nouvelle en synthèse « asymétrique », des scientifiques bordelais ont pu accéder à sélectivement à chacun de ces deux énantiomères au travers d'une seule et même séquence réactionnelle.
Le (+)-myrioneurinol est un alcaloïde naturel isolé en 2007 de Myrioneuron nutans, un arbuste que l'on retrouve principalement en Asie du Sud-Est. Les activités antipaludiques, anti-inflammatoires ou antimicrobiennes de ce métabolite incitent les scientifiques à mettre au point des voies de synthèse permettant de l’obtenir en plus grande quantité de manière synthétique.
Mais sa synthèse en laboratoire n’est pas si simple car sa structure complexe arbore plusieurs centres « asymétriques » (ou chiraux). Chaque centre peut alors présenter deux arrangements différents dans l’espace, images l’un de l’autre dans un miroir et non superposables, menant à deux énantiomères notés (+) et (-). Bien que possédant une composition chimique identique, ces deux énantiomères peuvent faire état de propriétés biologiques très différentes. Il est donc important de pouvoir les obtenir séparément.
Pour cela, plusieurs stratégies de synthèse peuvent-être anticipées. L’une d’entre elle consiste à produire directement et spécifiquement l’un des deux énantiomères par synthèse totale « asymétrique » ; une voie d'accès ne permettant donc d'isoler qu'un seul des deux énantiomères. Une autre stratégie peut reposer sur la séparation finale des énantiomères à partir d'un mélange racémique, mais celle-ci est conditionnée par la séparabilité des deux énantiomères via des techniques existantes. Une dernière peut enfin être basée sur la séparation plus aisée de paires de diastéréoisomères, mais cette approche implique systématiquement des étapes additionnelles liées à l’utilisation d’auxiliaires chiraux.
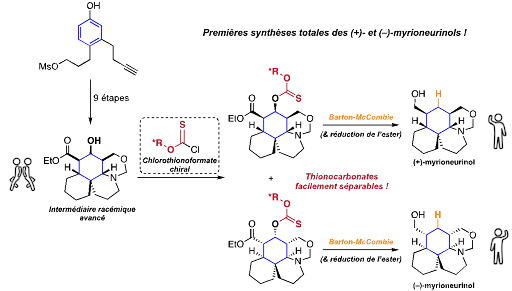
Ce que sont parvenus à réaliser des scientifiques de l'Institut des sciences moléculaires de Bordeaux (CNRS/Université de Bordeaux/Bordeaux INP) est de rendre cette dernière option plus efficace en s'affranchissant de ces étapes additionnelles. Pour accéder aux deux énantiomères du myrioneurinol, ils ont ainsi revisité l'avant-dernière étape de synthèse qui fait intervenir la réaction de Barton-McCombie, bien connue depuis plus de 50 ans. Ils ont ainsi développé un réactif chiral de type chlorothionoformate capable de faire d'une pierre deux coups : ce dernier permet non-seulement de désoxygéner un intermédiaire avancé, mais aussi de séparer les deux énantiomères de la séquence réactionnelle racémique mise en œuvre. Un résultat qui fait l’objet d’un dépôt d'un brevet (FR2408269) en 2024.
Les scientifiques bordelais cherchent maintenant à introduire des modifications du squelette hydrocarboné de chaque énantiomère du myrioneurinol afin de voir s’il est possible d’en exacerber les activités biologiques. Ils souhaitent également voir s’il est possible d’adapter ce nouveau mode de synthèse à d’autres alcools complexes obtenus de manière racémique. Cette avancée est parue dans Chemistry - a European Journal.
Rédacteur : CCdM
Référence
Adrien Denizet, Rajesh Nomula, Richard Edwards, Patrick Y. Toullec & Philippe A. Peixoto
Asymmetric Total Synthesis of (+)- and (–)-Myrioneurinol employing a "resolutive" late-stage Barton-McCombie Deoxygenation
Chem. Eur. J. 2025
https://doi.org/10.1002/chem.202500267