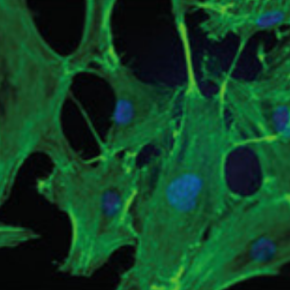
Un protocole novateur pour induire la différenciation de cellules souches adultes vers un lignage osseux
Des scientifiques de l’Institut de chimie et biologie des membranes et des nano-objets (CNRS/Université de Bordeaux/Bordeaux INP) proposent la synthèse, en laboratoire, d'une plateforme bioactive qui faciliterait la différenciation des cellules souches adultes humaines vers un lignage osseux, une étape cruciale en ingénierie tissulaire. Ces recherches qui rendent possible la production de quantités cliniquement significatives de cellules différenciées, de tissus et d'organoïdes fonctionnels, ouvrent de nouvelles perspectives dans le domaine de la réparation tissulaire reposant sur l'utilisation de cellules souches adultes.
Les cellules souches mésenchymateuses (MSC), cellules multipotentes, ont été et sont largement utilisées en ingénierie tissulaire en raison de leur capacité à se différencier vers différents lignages tels que les cellules du cartilage (chondrocytes), les cellules osseuses (ostéoblastes), les cellules graisseuses (adipocytes), ou des cellules musculaires (myocytes). Les hMSC offrent ainsi de vastes perspectives d'application dans le domaine de l'ingénierie tissulaire.
Les progrès récents en ingénierie tissulaire et en médecine régénérative reposent sur des protocoles induisant une différenciation de hMSC avant leur transplantation in vivo. Cependant, la production ex vivo de quantités cliniquement pertinentes de cellules fonctionnelles parfaitement différenciées reste problématique dans les applications d’ingénierie tissulaire. En effet, la rareté des hMSC associée à des protocoles de différenciation inefficaces rend actuellement difficile l'obtention d'une quantité pertinente de cellules osseuses différenciées, de tissus et d'organoides.
Pour contrôler la différenciation des hMSCs vers un lignage ostéogénique*, les scientifiques de l’Institut de chimie et biologie des membranes et des nano-objets (CNRS/Université de Bordeaux/Bordeaux INP) ont choisi de fonctionnaliser la surface d’un polymère (PET**) avec des peptides*** bioactifs dans le but de favoriser non seulement l’adhésion mais aussi la différenciation des hMSC vers un lignage osseux. Ces peptides ont été immobilisés de manière aléatoire à la surface du PET par liaison covalente, via une méthode de pulvérisation. C’est la première fois que ce mode de dépôt sur surface est mis en œuvre pour synthétiser des surfaces présentant des micromotifs bioactifs désordonnés à l'échelle micro/nanométrique afin d'étudier leur impact sur la différenciation de hMSC.
L’immobilisation des peptides en surface du polymère, la distribution des peptides greffés sur la surface, la rugosité des surfaces ont été vérifiées par spectroscopie photoélectronique à rayons X (XPS), microscopie à force atomique (AFM), microscopie à fluorescence, spectrométrie de masse des ions secondaires à temps de vol (ToF-SIMS). La différenciation des hMSC a ensuite été évaluée par immunocytochimie. Les résultats montrent que des surfaces présentant des micromotifs de peptides désordonnés favorisent la différenciation en ostéoblastes mais aussi en ostéocytes. Cette étude met en évidence pour la première fois la différenciation in vitro des hMSC en ostéocytes en utilisant des surfaces en 2 dimensions contenant des micromotifs désordonnés.
L’objectif final est de concevoir une plateforme bioactive peu coûteuse, facile à synthétiser et à manipuler pour produire rapidement et en grande quantité des cellules osseuses (ostéoblastes ou ostéocytes) à partir de hMSC provenant d'un patient.
* L'ostéogénie se réfère à la création, la croissance et au développement des os. Ce processus assure la régénération et la réparation des os suite à une fracture ou une usure normale.
** Poly(téréphtalate d'éthylène)
*** Peptide RGD favorisant l’adhésion cellulaire, et un peptide mimétique de la protéine BMP-2 favorisant la différenciation ostéogénique.
Rédacteur : CCdM

Référence
Yujie Zhang, Murielle Rémy, Evgeny Apartsin, Emilie Prouvé, Cécile Feuillie, Christine Labrugère, Nithavong Camb & Marie-Christine Durrieu
Controlling differentiation of stem cells via bioactive disordered cues
Biomaterials science 2023
https://pubs.rsc.org/en/content/articlelanding/2023/BM/D3BM00605K