Un muscle biomimétique autonome alimenté par du sucre et de l’air
Des chimistes du CNRS ont développé un système miniaturisé capable de se mettre en mouvement de façon autonome. Leur dispositif à base d’un polymère conducteur biocompatible utilise du sucre et de l’oxygène pour déployer un mouvement périodique qui ressemble à celui des battements du cœur. Ces muscles artificiels biomimétiques aux applications potentielles en robotique et biomédecine sont à découvrir dans Nature Communications.
Les muscles artificiels sont des dispositifs biomimétiques très recherchés pour leurs applications potentielles en robotique, nanotechnologie et biomédecine. Parmi les options possibles, les polymères conducteurs sont les plus étudiés car leur mouvement peut être déclenché à de faibles tensions électriques, comparables à celles présentes dans les muscles des mammifères. L’action est en général électromécanique et repose sur une grande variation de volume du polymère induite par des réactions électrochimiques d’oxydation et/ou de réduction. La déformation qui en résulte permet à ces actionneurs de déployer d’importantes forces mécaniques nécessaires pour développer des dispositifs de type muscle artificiel. Cependant, contrairement aux muscles naturels, les actionneurs basés sur des polymères synthétiques nécessitent une connexion physique à une alimentation électrique pour déclencher la déformation. Ce point limite considérablement les applications possibles.
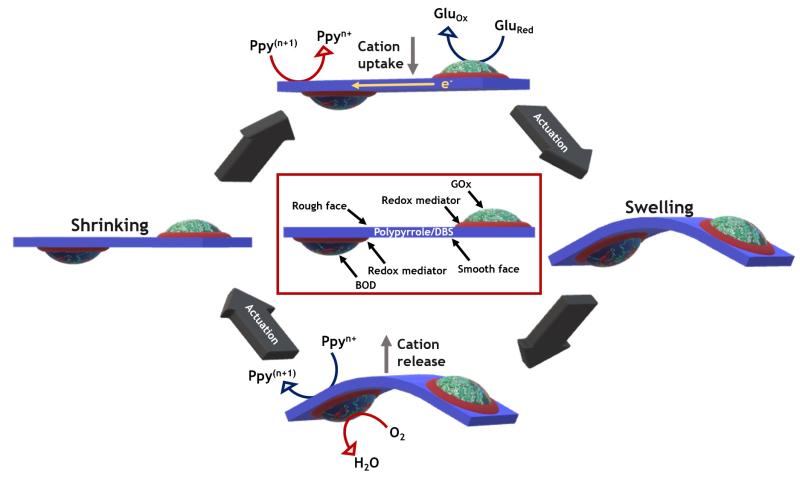
Des chimistes de l’Institut des sciences moléculaires (CNRS/Institut polytechnique de Bordeaux/Université de Bordeaux) et du Centre de Recherche Paul Pascal (CNRS/Université de Bordeaux), en collaboration avec des collègues de l’Université de Milan, ont récemment mis au point une alternative innovante basée l’utilisation de réactions enzymatiques pour fournir la force motrice nécessaire au fonctionnement de l’actionneur. Ce dernier est constitué d’un film de polymère conducteur modifié par deux enzymes aux actions complémentaires et plongé dans une solution contenant du glucose.
A une extrémité et sur la face supérieure du film, l’enzyme glucose-oxydase (GOx) oxyde le glucose. Cette oxydation libère des électrons transmis dans le film de polymère. Ces électrons circulent vers l’autre extrémité du film conducteur. Pour conserver sa neutralité électrique, ce dernier se gonfle simultanément en absorbant des ions positifs présents dans la solution. Ce gonflement induit une courbure du film qui se soulève. Arrivés à l’autre bout du film, les électrons sont utilisés cette fois par l’enzyme bilirubine-oxydase (BOD) déposée sur la face inférieure et qui catalyse la réduction de l’oxygène dissout dans la solution. Cette réduction s’accompagne d’un dégonflement du film qui relargue les ions positifs absorbés et par conséquent retourne à son état d’origine.
Les deux enzymes travaillent donc en synergie pour catalyser deux réactions complémentaires qui fournissent suffisamment de force motrice pour déclencher une déformation périodique du film qui ressemble à un battement de cœur (vidéo 1). Cette déformation oscillante peut se transformer en un mouvement dirigé et autonome du film de polymère à travers la solution (vidéo 2). Entraîné par des carburants physiologiquement disponibles, le glucose et l’oxygène, ce dispositif innovant ouvre des applications intéressantes en tant que matériau dynamique multifonctionnel qui imite véritablement les muscles naturels. Ces résultats, parus dans la revue Nature Communications, ont été obtenus dans le cadre d’une étude financée par le European Research Council (ERC) dans le programme de recherche et innovation Horizon 2020 de l’Union européenne.
Rédacteur: AVR
Mouvement périodique de l'actionneur polymère biomimétique
Audiodescription
Déplacement autonome de l'actionneur polymère biomimétique
Audiodescription
Référence
Bi-enzymatic chemo-mechanical feedback loop for continuous self-sustained actuation of conducting polymers
Serena Arnaboldi, Gerardo Salinas, Sabrina Bichon, Sebastien Gounel, Nicolas Mano & Alexander Kuhn
Nature Communications 2023.
https://doi.org/10.1038/s41467-023-42153-1
