Synthèse de molécules chirales : la piste inattendue des phosphanediides
Dans le cadre d’une collaboration entre le laboratoire Chimie organique, bioorganique : réactivité et analyse (COBRA – CNRS/ INSA Rouen/Université Rouen Normandie) et le Laboratoire de chimie moléculaire et thio-organique (LCMT – CNRS/ENSICAEN/ Université Caen Normandie), des chercheurs ont mis au point une approche originale pour produire des phosphanediides, composés pourtant très instables, en vue d’obtenir des phosphines chirales. Ces molécules clés, notamment pour l’industrie pharmaceutique, permettent dans de nombreux cas d’orienter la synthèse chimique vers la molécule aux propriétés biologiques souhaitées. Ces travaux sont parus dans la revue Chemistry - A European Journal.
Nombre de réactions de synthèse aboutissent à la formation d’une molécule chirale, soit une molécule présente sous deux formes différentes, appelées énantiomères, aux propriétés biologiques parfois très éloignées. Une caractéristique contraignante en particulier lors de la synthèse de molécules thérapeutiques, puisqu’un énantiomère peut avoir une activité biologique et l’autre être inactif, voire nocif. Dans les années 60, les conséquences ont été très graves dans le cas du thalidomide, ce sédatif prescrit aux femmes enceintes dont un énantiomère s’est révélé toxique pour l’embryon. Dès lors, l’enjeu a consisté à séparer les énantiomères pour les analyser séparément, ou à orienter la synthèse vers l’énantiomère souhaité, en utilisant un auxiliaire chiral. Les phosphines chirales (formées d’un atome de phosphore lié à trois groupements distincts) comptent aujourd’hui parmi les auxiliaires les plus utilisés dans l’industrie chimique. Cependant, les procédés de fabrication de ces phosphines, et en particulier des plus efficaces d’entre elles, les phosphines chirales P-stéréogéniques 1 , s’avèrent particulièrement couteux et complexes, ce qui tend à limiter leur utilisation.
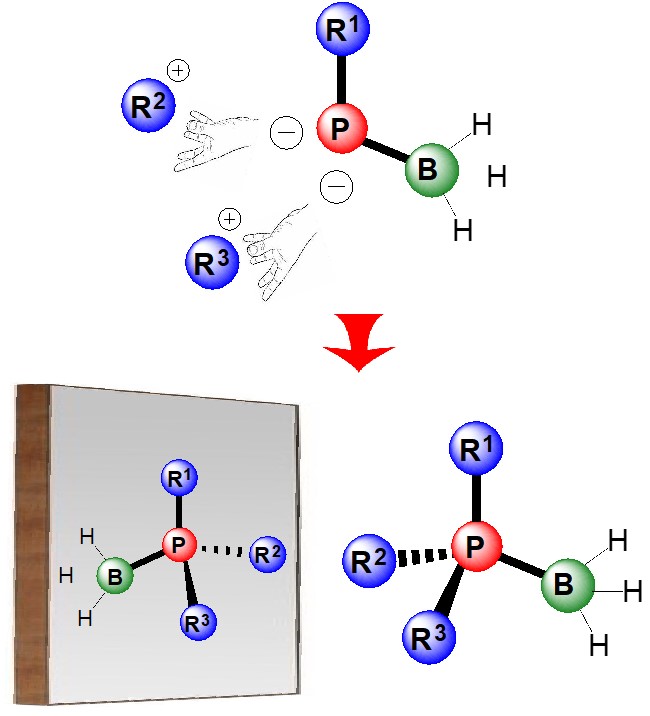
C’est là l’intérêt des travaux menés par des chercheurs du laboratoire Chimie organique, bioorganique : réactivité et analyse (COBRA – CNRS/ INSA Rouen/Université Rouen Normandie) et du Laboratoire de chimie moléculaire et thio-organique (LCMT – CNRS/ENSICAEN/ Université Caen Normandie) : proposer une méthode originale, plus aisée pour produire ces précieuses molécules. Comment ? En élaborant des précurseurs des phosphines, des phosphanediides, facilement transformables en phosphines chirales. Le premier challenge pour les chercheurs a été de stabiliser ces précurseurs qui sont en fait des intermédiaires réactionnels et, par essence, très instables. En s’appuyant sur l’expertise de l’équipe caennaise dans l’élaboration de phosphines et l’étude de leur réactivité, ils ont mis au point des phosphanediides particuliers, stabilisés par une liaison de l’atome de phosphore à un groupement borane (BH3). Les phosphanediides boranes obtenus ([BH3-P-R]2-) ont été analysés grâce à une technique de pointe de spectroscopie RMN 2 développée au sein du laboratoire rouennais pour étudier les intermédiaires réactionnels, savoir-faire dont il est leader en France. Ainsi, pour la première fois, la structure de phospanediides a pu être caractérisée avec précision, dans les conditions réelles des réactions de synthèse (en solution dans les solvants THF ou toluène-THF). Outre une connaissance fine de ces espèces et de leur réactivité, ces travaux fournissent des phosphanediides désormais manipulables à volonté, permettant d’accrocher des groupements variés sur le phosphore et, de fait, de concevoir les phosphines chirales P-stéréogéniques si convoitées. La mise au point de ces composés devrait ainsi donner un nouvel élan au domaine de la synthèse énantiosélective des molécules chirales.
©A. Harrison-Marchand
Références
Anne Harrison-Marchand, Jie Guang, Romain Duwald, Jacques Maddaluno, Hassan Oulyadi, Sami Lakhdar, Annie-Claude Gaumont.
Synthesis and Identification of Aryl and Alkyl Gem‐Dilithium Phosphido‐Boranes: A Boost to the Chemistry of Phosphandiides.
Chemistry A European Journal – Mars 2018
DOI : 10.1002/chem.201800742