Métalloenzymes : comment des acides aminés distants du site actif impactent leur réactivité
On considère habituellement que l’activité catalytique de métalloenzymes comme les hydrogénases, utilisées pour la production de dihydrogène, est déterminée par les premiers voisins des ions métalliques de leur site actif. Des scientifiques du Laboratoire de bioénergétique et ingénierie des protéines (CNRS, Aix-Marseille Université) et des Universités de Bochum (Allemagne) et de Turin (Italie) viennent de montrer dans la revue Nature Communications comment des acides aminés bien plus éloignés du métal conditionnent également la réactivité de l'hydrogénase de la bactérie Clostridium beijerinckii. Paramètre qu’il faudra prendre en compte pour optimiser la synthèse de catalyseurs biomimétiques encore plus performants pour la production d’hydrogène vert.
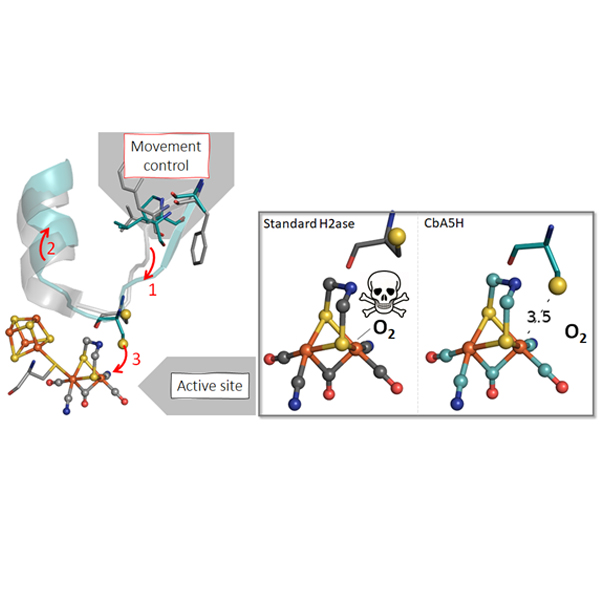
Les hydrogénases sont des métalloenzymes qui utilisent des sites actifs à base de métaux comme le fer ou le nickel pour catalyser la production de dihydrogène. D’où l’intérêt que leur portent les scientifiques pour la production bioinspirée de dihydrogène. Contrairement à la grande majorité des hydrogénases à base fer, les scientifiques ont observé que le site actif de l'hydrogénase de la bactérie Clostridium beijerinckii n'est pas détruit par l'oxygène. En effet, dans le cas de cette enzyme, un acide aminé de la seconde sphère de voisins se lie directement à l'ion fer, empêchant ainsi la fixation du dioxygène en protégeant sa sphère de coordination.
Pour comprendre l’origine de ce comportement singulier, une équipe du laboratoire de Bioénergétique et ingénierie des protéines a caractérisé ce système par cristallographie, spectroscopie infra-rouge, électrochimie et mutagenèse dirigée. Jusqu’à maintenant, on considérait que les acides aminés situés à grande distance du site actif, dans la sphère externe, intervenaient principalement dans le transport des substrats et produits de l'enzyme issus de la réaction catalytique : électrons, protons et dihydrogène. Les résultats de cette étude montrent que c’est la géométrie et l’encombrement de ces acides aminés, pourtant situés à 13 ångströms du fer, qui forcent l’acide aminé de la seconde sphère de voisins à se lier au fer, le protégeant ainsi de sa destruction par l’oxygène.
Cette étude montre que les propriétés de l'enzyme ne sont pas uniquement dictées par l'environnement immédiat du site actif métallique, et que les acides aminés situés à plus longues distances, dont la nature peut être très variable d’une enzyme à l’autre, participent également au contrôle de sa réactivité.
Rédacteur : CCdM
Référence
Martin Winkler, Jifu Duan, Andreas Rutz, Christina Felbek, Lisa Scholtysek, Oliver Lampret, Jan Jaenecke, Ulf Peter Apfel, Gianfranco Gilardi, Francesca Valetti, Vincent Fourmond, Eckhard Hofmann, Christophe Léger & Thomas Happe
A safety cap protects hydrogenase from oxygen attack
Nature Communications 12, Article number: 756 (2021)