Maladie d'Alzheimer : le précurseur amyloïde décrypté
Une équipe de l’Institut de Chimie de Strasbourg (CNRS/Université de Strasbourg) a caractérisé la structure d’un domaine de la protéine précurseur de l’amyloïde impliqué dans la maladie d’Alzheimer. Ces travaux sont parus dans ACS Omega.
La maladie d'Alzheimer est la forme de démence la plus courante, avec environ 50 millions de personnes touchées dans le monde. Dans le cadre du réseau européen de recherche et de formation Marie-Curie Action: BIOCONTROL, l'équipe Biophysique des Membranes et Résonance Magnétique de l’Institut de Chimie de Strasbourg (CNRS/Université de Strasbourg) et une équipe de l'Université Libre de Bruxelles se sont intéressées à la structure d’une protéine impliquée dans cette maladie, la protéine précurseur amyloïde.
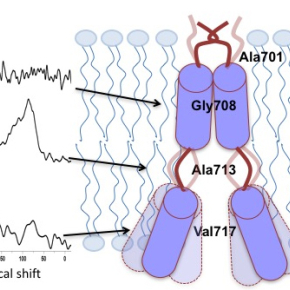
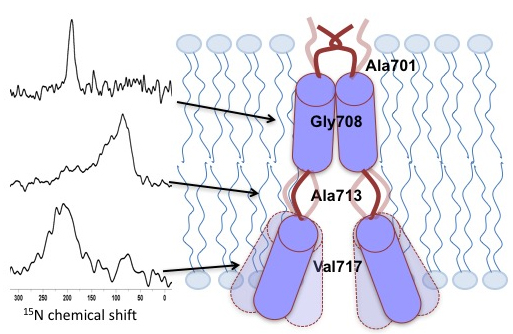
En effet, l’origine et la progression de la maladie d’Alzheimer ont été associées au peptide β-amyloïde (Aβ). Celui-ci est issu du clivage, par une protéase, de la protéine précurseur amyloïde, une protéine membranaire concentrée dans les synapses des neurones et comportant un unique domaine transmembranaire. Cette scission de la protéine est favorisée par la membrane cellulaire qui est une bicouche lipidique (avec une structure très fine en comparaison de son étendue) : les interactions bicouches jouent donc un rôle important dans le développement de la maladie.
Les chercheurs ont étudié l'intégrité structurale du domaine transmembranaire dans des bicouches lipidiques. Ils ont déterminé la distribution de l'angle d'inclinaison de ce domaine par rapport à ces bicouches, ainsi que la dynamique des différents sous-domaines par Résonnance Magnétique Nucléaire (RMN) à l'état solide et par spectroscopie infrarouge à transformée de Fourier (ATR-FTIR) : une hétérogénéité conformationnelle et topologique prononcée a été observée pour le site de clivage g et dans une moindre mesure pour le site z. Cette grande flexibilité des sites pourrait avoir de fortes répercussions sur le clivage de la protéine précurseur amyloïde, donc sur la production de peptide Aβ et de ses homologues. Ces résultats mènent donc à une meilleure compréhension des mécanismes de la maladie d’Alzheimer, voire à des innovations thérapeutiques.
Références
Anna Itkin, Evgeniy S. Salnikov, Christopher Aisenbrey, Jesus Raya, Elise Glattard, Vincent Raussens, Jean-Marie Ruysschaert, Burkhard Bechinger
Structural characterization of the amyloid precursor protein transmembrane domain and its gamma-cleavage site.
ACS Omega – Octobre 2017
DOI: 10.1021/acsomega.7b00619