La chimie du protactinium revisitée par les calculs quantiques
Les actinides* sous forme ionique forment fréquemment, en solution, des liaisons chimiques appelées « oxo »**. Ce comportement est lié à la charge élevée des ions actinides, à leur structure électronique et leur affinité pour l’oxygène.
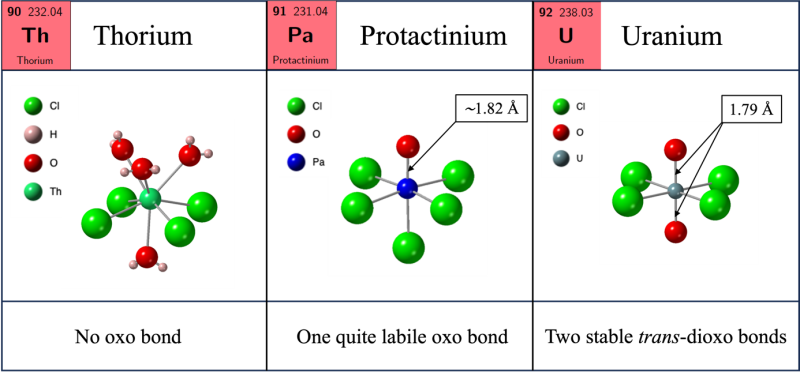
Positionné entre le thorium et l’uranium dans la classification périodique, le protactinium présente un comportement singulier. En solution, alors qu’aucune liaison oxo ne se forme avec le thorium et que deux liaisons oxo peuvent se former avec l’uranium ou certains transuraniens (voir figure), le protactinium serait quant-à-lui susceptible de ne former qu’une seule liaison oxo. Pour caractériser cette liaison, la distance interatomique est un paramètre déterminant. Très schématiquement, plus la liaison est courte, plus elle est covalente et stable, et plus la multiplicité de la liaison est élevée (liaison double, triple…).
Cependant, déterminer expérimentalement la distance Pa–Ooxo en solution reste complexe. Non content d’être radioactifs, les composés à base de protactinium sont sujets à la précipitation, à l’adsorption et à l’hydrolyse, ce qui fait que peu de données structurales dignes de confiance ont pu être obtenues jusqu’à présent. Les quelques systèmes étudiés par spectroscopie d’absorption ou par diffraction de rayons X, comme par exemple le complexe [PaOCl5]2-, conduisent à une distance Pa–Ooxo d’environ 1.75 Å, bien plus courte que celles observées dans les analogues dioxo [UOCl4]2- qui sont plutôt de l’ordre d’1.80 Å. Résultats en contradiction avec les expériences qui tendent à montrer que l’entité [UO2]2+ est bien plus stable en solution que l’entité [PaO]3+, ce qui devrait se traduite par une liaison U–Ooxo plus courte que Pa–Ooxo, toutes choses égales par ailleurs.
Des scientifiques de l’Institut des sciences chimiques de Rennes (CNRS/Université de Rennes/ENSCR/INSA Rennes), dans le cadre d’une collaboration avec d’autres équipes françaises***, ont modélisé différents systèmes solides et moléculaires à l’aide de méthodes de calculs de la chimie du solide, de la dynamique moléculaire et de la structure électronique. Leurs résultats prédisent une distance de liaison Pa–Ooxo supérieure à 1.80 Å, au-delà des distances typiquement observées pour l’uranyle, et donc une multiplicité effectivement plus faible. Ces résultats pourraient expliquer pourquoi la liaison Pa–Ooxo est relativement rare en solution et montrent qu’elle n’est pas complètement analogue aux liaisons U–Ooxo, contrairement à ce que l’on pensait auparavant.
* Un actinide est un atome lourd radioactif dont le numéro atomique est compris entre 89 (actinium, Ac) et 103 (lawrencium, Lr).
** « Oxo » est un terme utilisé pour décrire une liaison entre un atome d'oxygène et un autre atome lorsqu'elle implique une liaison double, voire triple.
*** Laboratoire de physique des lasers atomes et molécules, IJCLab, CEA/DAM/DIF, Subatech et le laboratoire « Chimie et interdisciplinarité, synthèse, analyse, modélisation ».
Rédacteur : CCdM
Référence
T. Shaaban, H. Oher, J. Aupiais, J. Champion, A. S. P. Gomes, C. Le Naour, M. Maloubier, F. Réal, E. Renault, X. Rocquefelte, B. Siberchicot, V. Vallet & R. Maurice
Is the protactinium(V) mono-oxo bond weaker than what we thought?
Chem. Commun. 2024
https://doi.org/10.1039/D4CC04522J