Des molécules qui ciblent à la fois l’infection et la transmission du paludisme
Parce qu’ils sont liés à un stéroïde, de nouveaux dérivés des ortho-aminocrésols, déjà connus pour leur action antipaludique, se révèlent plus efficaces pour tuer le parasite chez l’hôte infecté, mais aussi pour bloquer sa transmission vers le moustique vecteur. Ces travaux parus dans la revue Nature Communications sont le fruit d’une collaboration pluridisciplinaire et internationale 1 menée par des chercheurs d’universités allemandes, du Laboratoire de chimie moléculaire (CNRS/Université de Strasbourg) et de l’Institut de biologie moléculaire et cellulaire de Strasbourg (CNRS/Inserm/Université de Strasbourg).
- 1Institut Suisse en santé tropicale et publique (Swiss TPH) à Bâle, Institut-Leibniz de recherche en produits naturels et en biologie infectieuse (Hans Knöll Institute) à Jena, Instituts Sanford-Burnham-Prebys de découverte médicale (La Jolla - Californie et Orlando-Floride), Universités de Jena, Bâle, New York à Abu Dhabi et Giessen.
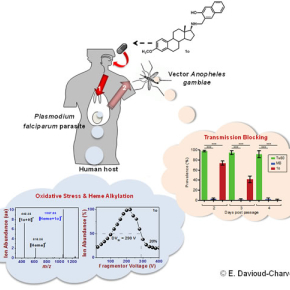
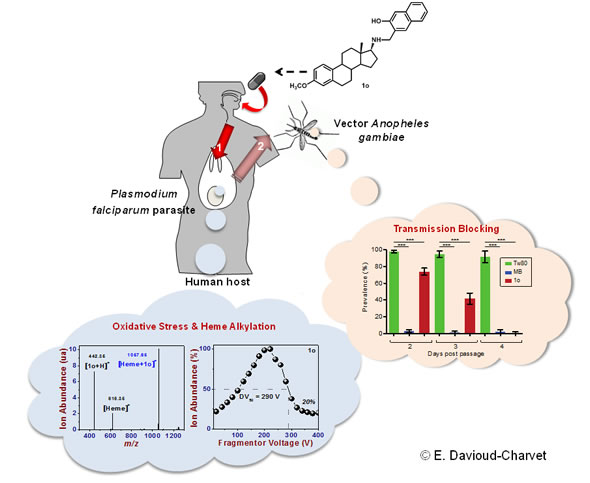
Maladie parasitaire la plus répandue au monde, le paludisme est transmis à l’homme par la piqûre d’un moustique infecté par le parasite Plasmodium. Une fois présent dans l’organisme humain, le parasite s’établit dans le foie puis envahit le système sanguin où il se nourrit de l’hémoglobine des globules rouges ; cette phase est à l’origine des symptômes de la maladie (fièvre et troubles digestifs) qui peuvent évoluer vers des complications graves, voire mortelles. Plusieurs familles chimiques sont connues pour leur activité antipaludique ; c’est le cas des ortho-aminocrésols (ou o-aminocrésols). Récemment, des chercheurs des universités allemandes de Jena et Giessen ont mis au point des dérivés d’o-aminocrésols liés à un stéroïde ; des composés inédits dont l’activité antiparasitaire s’est révélée beaucoup plus puissante que celle de leurs homologues non stéroïdes. Restait à élucider leur mode d’action… Spécialistes de la physicochimie médicinale et du cycle parasitaire du moustique, des chercheurs strasbourgeois du laboratoire de chimie moléculaire et de l’institut de biologie moléculaire et cellulaire, impliqués dans le Labex ParaFrap 2 , ont donc étudié l’effet de ces composés sur le mécanisme qui permet au Plasmodium de se développer : dégrader l’hémoglobine des globules rouges en acides aminés et neutraliser l’hème, composant toxique de l’hémoglobine libéré par cette dégradation, en le cristallisant sous une forme insoluble et inoffensive (hémozoïne ou pigment malarique).
Par des études de spectrométrie de masse notamment, les chercheurs ont mis en évidence les modes d’action combinés des nouveaux dérivés d’o-aminocrésols, expliquant ainsi leur puissante activité :
- en modifiant irréversiblement l’hème (par alkylation), ils empêchent sa cristallisation, à l’instar de la chloroquine 3 . Le parasite n’est dont plus protégé contre sa toxicité ;
- ils génèrent des espèces oxygénées réactives (ROS), autrement dit un stress oxydatif nocif pour le parasite ;
- enfin, grâce à leur liaison au stéroïde, ils pénètrent plus facilement dans l’organisme parasitaire.
Mais ce n’est pas tout. Étudiés sur un modèle in vivo de transmission de l’infection de la souris au moustique, ces nouveaux composés s’avèrent également actifs contre les formes sexuées du parasite (gamétocytes), responsables de la transmission vers le moustique et qui sont résistantes aux traitements classiques.
Très prometteurs, ces travaux ouvrent la voie vers de nouvelles stratégies efficaces pour lutter simultanément contre l’infection et la transmission du paludisme, mais aussi d’autres parasites hématophages…
Référence
Reimar Krieg, Esther Jortzik, Alice-Anne Goetz, Stéphanie Blandin, Sergio Wittlin, Mourad Elhabiri, Mahsa Rahbari, Selbi Nuryyeva, Kerstin Voigt, Hans-Martin Dahse, Axel Brakhage, Svenja Beckmann, Thomas Quack, Christoph G. Grevelding, Anthony B. Pinkerton, Bruno Schönecker, Jeremy Burrows, Elisabeth Davioud-Charvet, Stefan Rahlfs & Katja Becker
Arylmethylamino steroids as antiparasitic agents
Nature Communications 17 février 2017
doi: 10.1038/NCOMMS14478