Des foldamères à la rescousse des peptides thérapeutiques
Des chercheurs de la start-up UREkA associés aux chercheurs de l’Institut de chimie et biologie des membranes et nano-objets (CNRS/Université de Bordeaux/IPB, équipe IECB) ont proposé une nouvelle approche basée sur des molécules artificielles appelées « foldamères » pour améliorer les propriétés de peptides thérapeutiques. Leur technologie baptisée UrelixTM permet d’augmenter très significativement la stabilité, les propriétés pharmacologiques et la durée d’action de ces peptides. Ces résultats sont parus dans la revue Nature Communications.
Malgré leur activité biologique variée, leur diversité moléculaire et structurale, et une production maitrisée par voie chimique, les propriétés thérapeutiques des peptides, molécules utilisées par exemple comme antibiotiques, antiviraux, antifongiques, anti-inflammatoires ou encore pour le traitement de maladies métaboliques, pourraient encore être améliorées. Par exemple, leur structure même leur confère une forte vulnérabilité aux enzymes peptidases et donc une demi-vie et une durée d’action potentiellement faibles.
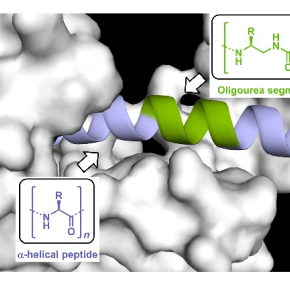
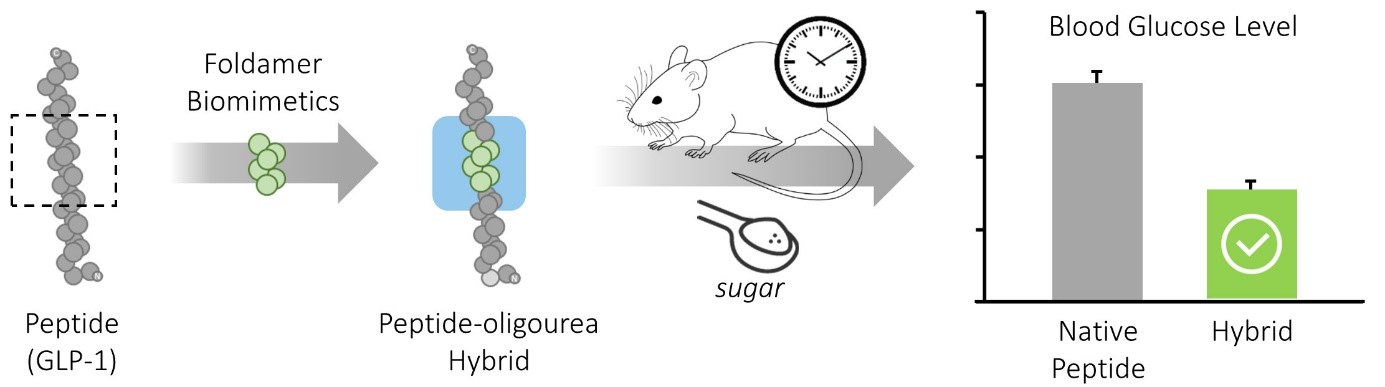
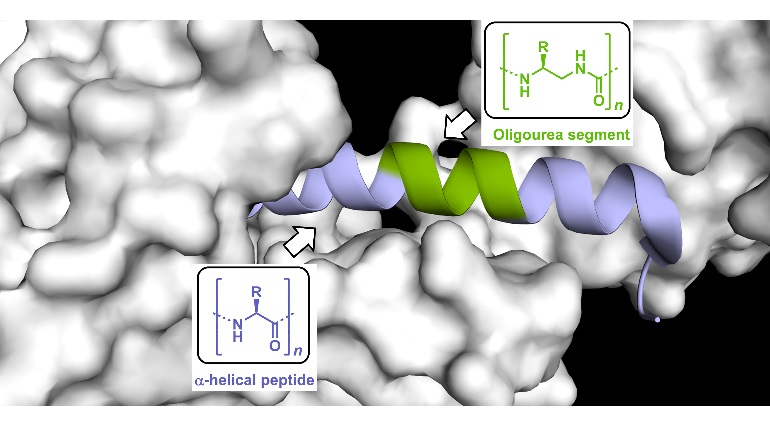
Pour pallier ces limitations, des scientifiques1 du laboratoire Chimie et biologie des membranes et nanoobjets (CNRS/Université de Bordeaux/Bordeaux INP) et de la start-up UREkA se sont penchés sur l’utilisation de foldamères2 . Ils ont démontré que ces molécules pouvaient être utilisées comme inserts dans des peptides biologiquement actifs : elles remplacent alors des segments peptidiques spécifiquement choisis, sans perturber ni la conformation active du peptide, ni ses propriétés de reconnaissance. Appliqué à des hormones gastro-intestinales de la famille des incrétines comme le glucacon-like peptide 1 (GLP-1), connues pour être très rapidement dégradées par les peptidases, cette technologie baptisée UrelixTM a permis d’augmenter très significativement la stabilité, les propriétés pharmacocinétiques et la durée d’action in vivo de ces peptides.
Ces travaux pourraient permettre à court terme de proposer des analogues stabilisés du GLP-1 à durée d’action prolongée pour le traitement du diabète de type 2. Au-delà, la technologie UrelixTM présente un potentiel d’exploitation plus vaste avec notamment la possibilité de moduler ou d’inhiber des interactions protéine-protéine pour lutter contre différentes pathologies.
Référence
Juliette Fremaux, Claire Venin, Laura Mauran, Robert H. Zimmer, Gilles Guichard & Sébastien R. Goudreau
Peptide-oligourea hybrids analogue of GLP-1 with improved action in vivo
Nature Communications 25 février 2019
DOI : 10.1038/s41467-019-08793-y