Des cellules humaines transformées en biocatalyseur
Des chercheurs de l’Institut de chimie moléculaire et des matériaux d'Orsay (Université Paris-Sud, Université Paris-Saclay/CNRS) ont conçu des enzymes artificielles ancrées à la surface de cellules humaines vivantes. Ces enzymes pourraient être utilisées à des fins thérapeutiques, produisant des composés pharmacologiques directement sur la surface de cellules spécifiques, ce qui pourrait réduire les effets secondaires. Ces résultats sont publiés dans la revue JACS.
Pour limiter les effets secondaires d’un médicament, celui-ci doit être délivré au plus près des cellules qu’ils visent. Mieux, les cellules cibles pourraient elles-mêmes fabriquer le médicament à partir d’un composé inactif assimilé par le patient. Des chercheurs de l’Institut de chimie moléculaire et des matériaux d'Orsay (Université Paris-Sud, Université Paris-Saclay/CNRS) ont démontré que cela est possible : ils ont transformé des cellules vivantes en biocatalyseurs, en intégrant des métalloenzymes artificielles à leur surface.
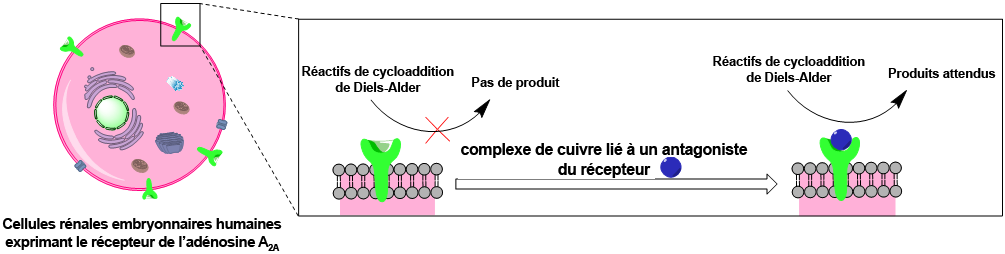
Des milliers d’enzymes naturelles facilitent chaque jour les nombreuses réactions chimiques qui se déroulent à l’intérieur des organismes vivants. Elles accélèrent, ou « catalysent », ces réactions chimiques qui, sans elles, seraient très lentes ou ne démarreraient pas. Les métalloenzymes sont de telles enzymes contenant un ion métallique, tel que le zinc, le fer ou le cuivre. Les métalloenzymes artificielles ont fait leur preuve en catalyse, mais les applications dans des cellules vivantes restent difficiles : le métabolisme de ces cellules endommage en effet les ions métalliques, empêchant la formation des enzymes. Pour contourner cette difficulté, l’équipe de recherche s’est concentrée sur la surface de la cellule.
Elle s’est intéressée au récepteur membranaire de l’adénosine A2A, une protéine naturellement présente à la surface de neurones mais que les scientifiques ont ici fait s’exprimer à la surface de cellules rénales embryonnaires humaines. Les chimistes ont ensuite intégré, de façon stable et spécifique, un complexe métallique à une molécule qui se lie à ce récepteur. Ce complexe contenant du cuivre est connu pour catalyser la réaction de Diels-Alder, une réaction utilisée pour synthétiser des médicaments, des produits agrochimiques et de nombreuses autres molécules.
Des tests expérimentaux montrent que cette métalloenzyme ancrée dans la membrane cellulaire catalyse elle aussi efficacement cette réaction de Diels-Alder. Or, à ce jour, encore aucune métalloenzyme naturelle, et aucune enzyme humaine connue, n’était capable de catalyser cette réaction utile.
Cette découverte du potentiel des métalloenzymes artificielles associant des complexes métalliques à des récepteurs membranaires est par conséquent un grand pas en avant pour la catalyse in vivo. Des enzymes artificielles pourraient ainsi être conçues pour se lier aux protéines présentes uniquement par exemple sur les cellules cancéreuses et y produire le médicament pour les détruire sélectivement.
©Wadih Ghattas
Référence
Wadih Ghattas, Virginie Dubosclard, Arne Wick, Audrey Bendelac, Régis Guillot, Rémy Ricoux, et Jean-Pierre Mahy
Receptor-Based Artificial Metalloenzymes on Living Human Cells
Journal of the American Chemical Society – Juin 2018
DOI: 10.1021/jacs.8b04326
JACS spotlight : https://pubs.acs.org/doi/10.1021/jacs.8b06941