Des catalyseurs à la sélectivité commutable
La plupart des synthèses de molécules chirales produisent plusieurs molécules appelées isomères, de même formule chimique brute mais qui ne se superposent pas en 3 dimensions. Pour beaucoup d’applications, il est nécessaire de les produire séparément car elles présentent parfois des propriétés très différentes. Des scientifiques du CNRS viennent de mettre au point un catalyseur unique capable de synthétiser préférentiellement chacun des isomères d’une molécule chirale.
Comme nos mains, les molécules chirales existent sous deux formes appelées énantiomères, de même formule chimique mais dont les structures sont images l’une de l’autre dans un miroir et non superposables. Deux énantiomères peuvent présenter des propriétés complètement différentes malgré leur apparente similitude.
La plupart des synthèses de molécules chirales produisent un mélange des deux énantiomères. Pour de nombreuses applications, notamment en chimie pharmaceutique ou dans le domaine des matériaux, il est donc nécessaire de les séparer ou de développer des moyens de les synthétiser sélectivement.
Pour orienter la production d’un isomère plutôt que l’autre, les chimistes ont développé de nombreux catalyseurs organométalliques. Cependant, les méthodologies de synthèse permettant d’accéder à chaque isomère d’une molécule chirale restent limitées et nécessitent de nombreux catalyseurs mettant en jeu des processus chimiques complexes encore mal compris. Et si un catalyseur unique permettait d’obtenir indépendamment chaque isomère d’une molécule chirale ?
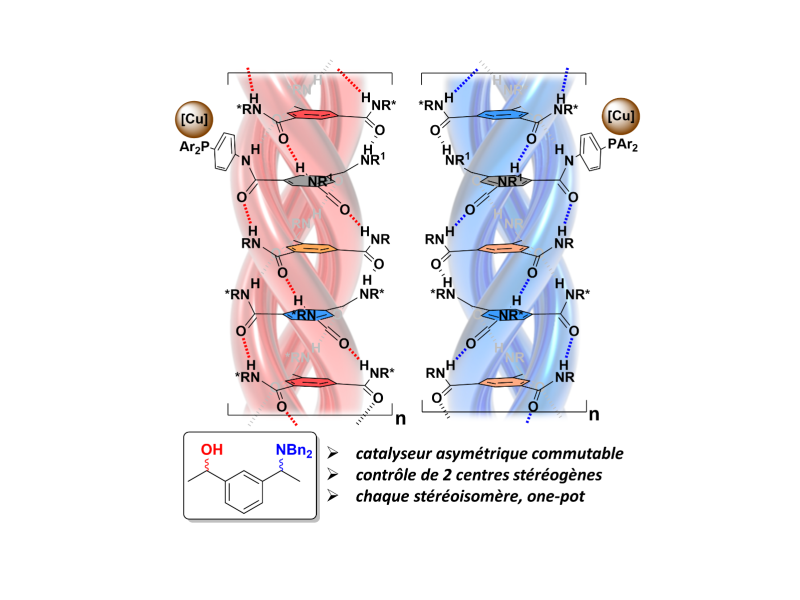
C’est ce que viennent de réaliser les scientifiques de l’Institut parisien de chimie moléculaire (CNRS/Sorbonne Université) qui ont pour cela réalisé une structure supramoléculaire hélicoïdale chirale à l’intérieur de laquelle un atome de cuivre forme le site catalytique. En jouant sur la nature chimique des entités moléculaires qui composent le catalyseur, ils sont parvenus à contrôler le sens de rotation de ses hélices et donc la nature de l’isomère obtenu. Mieux encore, ils peuvent modifier in situ le catalyseur en changeant le sens de rotation de l’hélice, ce qui revient à commuter la sélectivité du catalyseur au cours de la réaction.
Cette sélectivité, testée sur la synthèse d’un amino-alcool chiral, a permis d’obtenir des excès énantiomériques élevés (≥ 93%), avec ou sans commutation de la sélectivité. Une première étape vers des catalyseurs efficaces pour accéder rapidement à tous les isomères d’une molécule d’intérêt, à retrouver dans la revue Nature Communications.
Rédacteur : CCdM
Référence
Ran Chen, Ahmad Hammoud, Paméla Aoun, Mayte A. Martínez-Aguirre, Nicolas Vanthuyne, Régina Maruchenko, Patrick Brocorens, Laurent Bouteiller, & Matthieu Raynal
Asymmetric stereodivergent catalysis achieved by means of a switchable asymmetric catalyst built on supramolecular helices
Nature Communications, 2024, 15, 4116