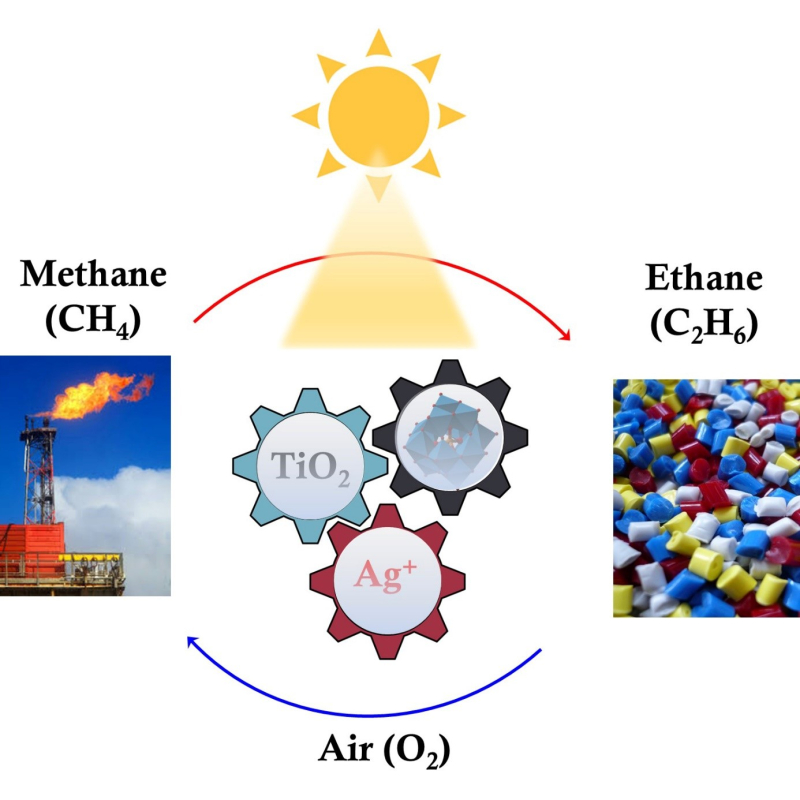
De l’argent pour une valorisation plus douce du méthane
Sous forme de gaz naturel ou de biogaz, le méthane est généralement brûlé pour produire de la chaleur, ce qui libère différentes molécules à fort effet de serre. Il peut à la place être transformé en éthane, afin de fabriquer des polymères, mais cette réaction consomme beaucoup d’énergie et laisse de nombreux déchets. Des chimistes de l’UCCS (CNRS/Université de Lille/Université Artois/Centrale Lille Institut), du GPM (CNRS/Université Rouen Normandie/INSA Rouen) et l’université de Keele (Royaume-Uni) ont donc développé un nouveau système, à base de catalyseurs d’argent. Ces travaux, publiés dans Nature Energy, permettent d’obtenir de l’éthane à température ambiante et avec moins de 10 % de déchets.
Extrêmement répandu sur Terre, le méthane est un gaz à effet de serre vingt-cinq fois plus important que le dioxyde de carbone (CO2). Extrait du sol ou issu de la décomposition de matières organiques, le méthane est principalement brûlé pour du chauffage ou la production d’énergie. Il pollue moins que le charbon ou le pétrole, mais libère tout de même de grandes quantités de CO2. Face à ce problème, d’autres pistes sont explorées pour valoriser ce gaz, comme le transformer en éthane, puis en éthylène. Cette brique essentielle de l’industrie chimique sert à concevoir de nombreux polymères. L'activation du méthane avant sa conversion demande cependant une température d’environ 1000 degrés, plusieurs étapes et laisse beaucoup de déchets, sous forme de coke et de CO2. Des chercheurs de l’Unité de catalyse et chimie du solide (UCCS, CNRS/Université de Lille/Université de l’Artois/Centrale Lille Institut), du Groupe de physique des matériaux (GPM, CNRS/Université Rouen Normandie/INSA Rouen) et l’université de Keele (Royaume-Uni) proposent une approche plus douce où des catalyseurs nanocomposites permettent d’obtenir cette réaction à température ambiante et avec moins de 10 % de déchets.
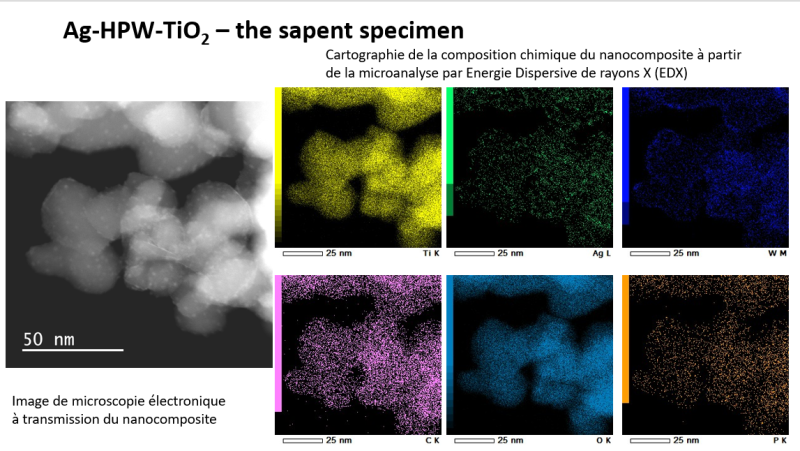
Ces nanocomposites, à base de l’argent et d’oxyde de titane, sont utilisés dans le cadre d’une boucle photochimique. Lors de la première étape, la réaction, le catalyseur nanocomposite transforme une molécule de méthane en éthane. Les nanocomposites noircissent d’ailleurs progressivement au contact de la lumière, un phénomène qui rappelle les principes de la photographie argentique. Ensuite, pendant la régénération, la lumière et l’oxygène réactivent les nanocomposites et l’opération peut être répétée jusqu’à épuisement du méthane. Les chercheurs ont également remarqué que plus il y a d’argent, plus le rendement en éthane est élevé. L’équipe va à présent tenter d’étendre ce principe à la conversion du méthane en d’autres produits chimiques que l’éthane.
[1] Combustible obtenu par pyrolyse du charbon.
Référence :
Xiang Yu, Vladimir L. Zholobenko, Simona Moldovan, Di Hu, Dan Wu, Vitaly V. Ordomsky & Andrei Y. Khodakov. Stoichiometric methane conversion to ethane using photochemical looping at ambient temperature. Nature Energy (2020).
