Cancer : une stratégie pour étudier des protéines désordonnées
Particulièrement souples, les protéines intrinsèquement désordonnées (PDI) sont difficiles à fixer, ou cristalliser, afin d’être étudiées. Or, leur compréhension représente un enjeu thérapeutique car elles jouent un rôle dans différentes maladies, dont des cancers. Des chercheurs de l’ISIS (CNRS/Université de Strasbourg) et de l’IGBMC (CNRS/Université de Strasbourg/INSERM) ont cependant réussi à cristalliser l’une d’entre elles, l’ACTR. Publiés dans la revue Chemical Science, ces travaux pourraient bénéficier à l’exploration d’autres PDI.
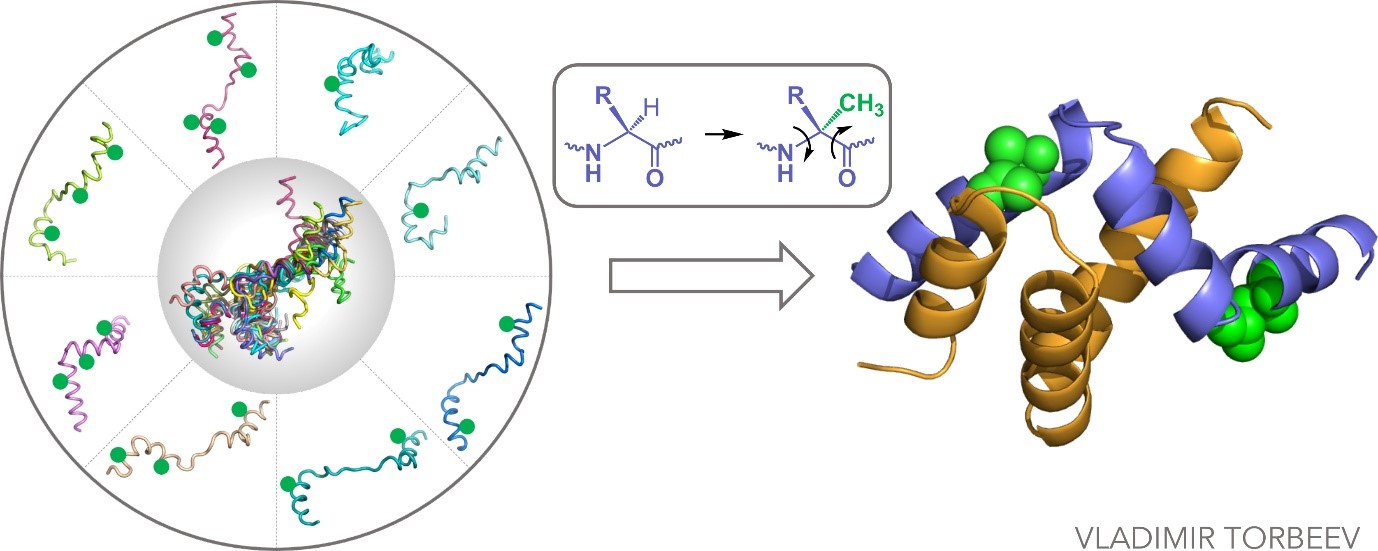
Les cellules eucaryotes contiennent en leur sein un protéome noir, ou dark proteome, constitué de protéines non identifiées, difficiles à cristalliser ou dont l’existence est prédite par la théorie, mais n’a pas encore été constatée. On y retrouve entre autres des protéines intrinsèquement désordonnées (PDI), qui ne présentent pas de structure tridimensionnelle stable. Elles forment environ un tiers du protéome des cellules eucaryotes, et leurs interactions avec les autres protéines peuvent causer des perturbations allant jusqu’à l’apparition de cancers et de maladies neurodégénératives. Leur instabilité empêche leur analyse qui passe par des méthodes cristallographiques, très courantes pour sonder les protéines bien repliées. Afin de pouvoir malgré tout étudier les PDI, des chercheurs de l’Institut de science et d’ingénierie supramoléculaires (ISIS, CNRS/Université de Strasbourg) et de l’Institut de génétique et de biologie moléculaire et cellulaire (IGBMC, CNRS/Université de Strasbourg/INSERM) proposent une stratégie où ils conçoivent différents variants jusqu’à fixer les PDI dans une structure stabilisée.
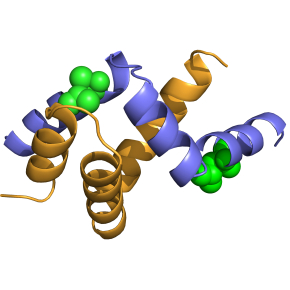
Ces travaux se sont focalisés sur la protéine ACTR, dont la surexpression est liée à différents cancers, comme ceux du sein et des poumons. Les chercheurs ont utilisé des acides aminés artificiels pour synthétiser une cinquantaine de variants de son domaine d’activation. Cette stratégie permet de fixer et d’isoler des structures des PDI par cristallisation, malgré leur instabilité et leurs changements rapides, afin de pouvoir les étudier par rayons X. Il s’agit d’ailleurs de la première fois que l’ACTR est cristallisée, et cette méthode pourrait s’appliquer aux autres PDI. Ces travaux vont également aider à comprendre comment l’ACTR influe sur le cancer, ainsi que de s’en servir comme sonde pour explorer les interactions protéines-protéines en oncologie.
Référence
Valentin Bauer, Boris Schmidtgall, Gergő Gógl, Jozica Dolenc, Judit Osz, Yves Nomine, Camille Kostmann, Alexandra Cousido-Siah, André Mitschler, Natacha Rochel, Gilles Travé, Bruno Kieffer & Vladimir Torbeev
Conformational editing of intrinsically disordered protein by alpha-methylation
Chem. Sci. (2021)