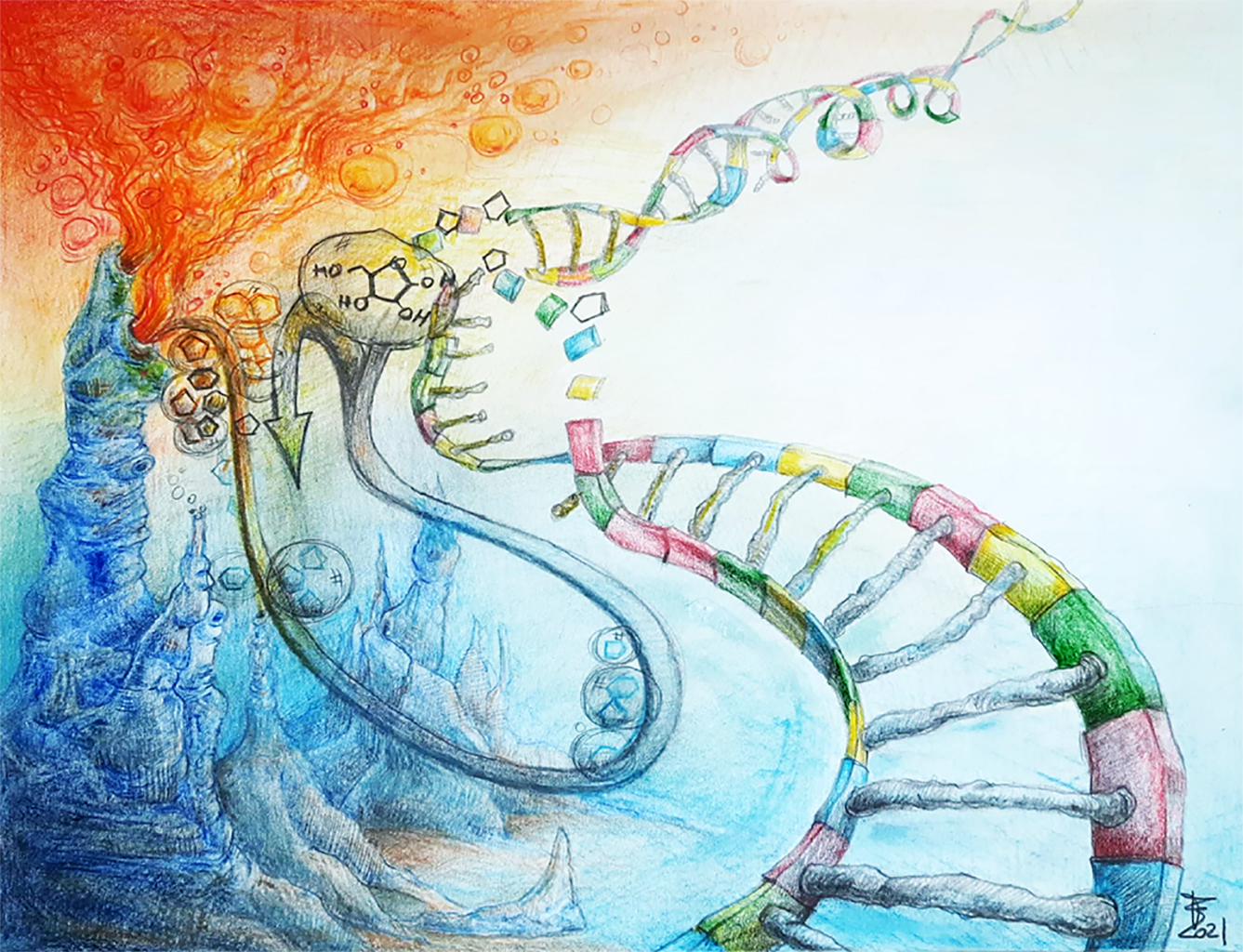
Comment l’environnement hydrothermal de la Terre Primitive a pu influencer le choix du sucre constitutif de l’ADN et de l’ARN
Pourquoi le furanose est-il le seul sucre que l’on retrouve dans la composition de l’ADN et l’ARN alors que cette forme de sucre n’est pas la plus stable, donc pas la plus abondante, dans les conditions de température et de pression que nous connaissons actuellement ? Ce sont les sources hydrothermales, omniprésentes à la surface de la Terre primitive, et leur influence thermique complexe, qui pourraient être à l’origine de cette sélectivité. Cette étude menée par les scientifiques du Centre de biophysique moléculaire (CNRS), qui fait l’objet d’un article dans la revue Nature Communications, devrait permettre de mieux comprendre pourquoi et comment les molécules s’assemblent pour donner la vie dans un contexte géologique primitif.
Dans l’ARN comme dans l’ADN, c’est un sucre, le ribose, qui joue le rôle de squelette. Il relie entre elles les couples de bases azotées à l’origine des brins qui s’enroulent les uns autour des autres pour former la structure bien connue en simple brin pour l’ARN ou en double hélice pour l’ADN. Comme la plupart des sucres, le ribose existe sous forme d'un mélange d’isomères*. Aux pressions atmosphériques et températures ambiantes que l’on connaît actuellement, la forme la plus stable et donc largement prédominante est le β-D-ribopyranose appelé pyranose. Le furanose, un isomère moins stable et donc moins abondant, est pourtant le seul isomère que l’on retrouve dans la composition de l’ADN et de l’ARN.
Pour expliquer cette surprenante sélectivité, les scientifiques du Centre de biophysique moléculaire (CNRS), grâce à mesures expérimentales en spectroscopie RMN et des calculs de physique statistique, ont mis en évidence une inversion de population entre le pyranose et le furanose qui devient l’espèce majoritaire, lorsque le milieu est soumis à un gradient de température. Cet état de « non-équilibre » pourrait favoriser l’utilisation préférentielle du furanose, maintenant plus abondant, pour former le squelette de l’ADN et l’ARN.
Ces travaux proposent ainsi un modèle capable d’expliquer l’augmentation de concentration en furanose au-delà des limites fixées par la thermodynamique à l'équilibre, dans les conditions de pression et de température que l’on retrouve dans des systèmes hydrothermaux. Des gradients de température similaires étant observés dans les environnements hydrothermaux sous-marins, le modèle proposé pourrait expliquer la sélection du furanose comme sucre de la vie il y a plus de 4 milliards d’années sur la Terre primitive, époque à laquelle les sources hydrothermales étaient omniprésentes.
* composés présentant la même formule chimique mais un enchainement différent des atomes dans la molécule.
Rédacteur : CCdM
Référence
Avinash Vicholous Dass, Thomas Georgelin, Frances Westall, Frédéric Foucher, Paolo De Los Rios, Daniel Maria Busiello, Shiling Liand & Francesco Piazza
Equilibrium and non-equilibrium furanose selection in the ribose isomerisation network
Nature Communications, 12 2749 (2021) https://www.nature.com/articles/s41467-021-22818-5
