De l’importance de la taille des protéines dans les interactions protéines-nanoparticules
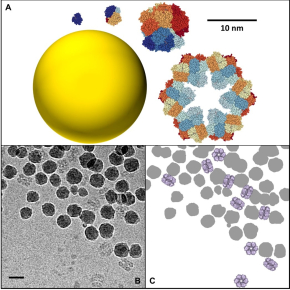
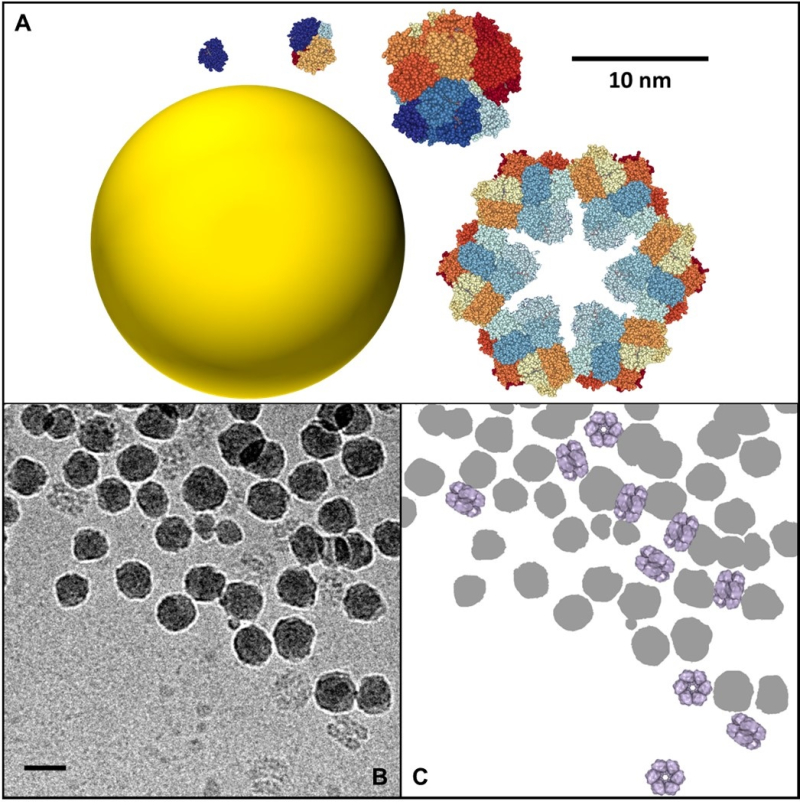
L’utilisation de nanoparticules (NP) en milieux biologiques est très répandue, tant dans le secteur environnemental qu’agro-alimentaire ou pharmaceutique. En nanomédecine, par exemple, elles sont utilisées pour prévenir ou soigner certaines maladies, pour le diagnostic in vivo, le relargage ciblé de médicaments et l’imagerie moléculaire. Lorsqu’une NP est plongée dans un milieu biologique comme le sang ou le mucus, une couche de protéines, appelée corona, s’adsorbe instantanément à sa surface et lui confère une nouvelle identité biologique qui peut conditionner sa bio-distribution, voire sa toxicité. La formation de cette corona dépend directement de la forme, la taille ou la charge électrique des protéines et des NP. Une équipe interdisciplinaire de scientifiques du laboratoire de Nanosciences et innovation pour les matériaux, la biomédecine et l'énergie (NIMBE- CNRS/CEA) et de l’Institut de biologie intégrative de la cellule (I2BC - CNRS/CEA/Université de PARIS SACLAY/INRAE/INSERM) s’est penchée sur les interactions protéines/NP1. Récemment, ils ont mis en évidence le rôle spécifique de la taille des protéines sur ces interactions. En utilisant une série d’hémoprotéines de base structurale et fonction identiques, mais dont la taille varie d’un facteur 1 à 144, ils ont pu mettre en évidence des mécanismes d’adsorption totalement différents sur des particules de silice de taille fixe. Ainsi, les petites protéines s’adsorbent sur les NP par des mécanismes purement enthalpiques via la création de liaisons entre la protéine et la surface de la NP. A contrario, les grosses protéines, d’une taille comparable à celle des NP, interagissent par des mécanismes entropiques analogues à ceux qui gouvernent les phénomènes d’auto-assemblage des colloïdes. Chaque protéine peut se lier directement à plusieurs NP et former des ponts dans ces nouveaux assemblages protéines/NP qui ont pu être directement observés pour la première fois par cryomicroscopie électronique. Ces observations, publiées dans la revue Langmuir, montrent qu’il est nécessaire d’aller au-delà du simple modèle de couronne pour comprendre comment les protéines affectent l’agrégation, et donc la distribution, des nanoparticules dans les organismes vivants et les milieux naturels.
Référence
From protein corona to colloidal self-assembly: the importance of protein size in protein-nanoparticle interactions L. Marichal, J. Degrouard, A. Gatin, N. Raffray, J.-C. Aude, Y. Boulard, S. Combet, F. Cousin, S. Hourdez, J. Mary, J.-P. Renault et S. Pin Langmuir (2020) 36, 8218–8230