La catalyse non linéaire hyperpositive : quand la nature amplifie la disymétrie
Certaines molécules existent en deux variantes symétriques, mais non superposables : les énantiomères. Malgré ce que l’on pourrait penser, ces deux versions ne sont pas présentes en quantités égales dans la nature, sans que l’on sache ni où ni quand ce déséquilibre est apparu dans l’histoire de la vie. Des chercheurs de l’Institut de physique et chimie des matériaux de Strasbourg (IPCMS, CNRS/Université de Strasbourg) ont prouvé qu’avec des catalyseurs pourtant en nombre quasiment égal, on pouvait favoriser grandement la formation d’un énantiomère au détriment de son image miroir. Ce n’est pourtant pas le cas avec ce même catalyseur lorsqu’il ne contient qu’une variante symétrique. Ces travaux, publiés dans la revue Nature Catalysis, montrent donc que la disymétrie peut s’amplifier uniquement en l’absence d’un déséquilibre fort dans les catalyseurs.
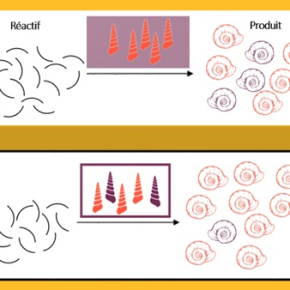
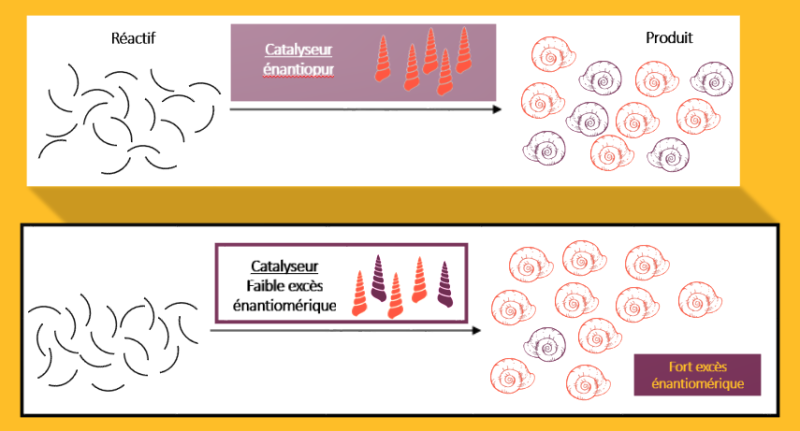
La chimie du vivant n’est pas symétrique. Lorsque deux molécules sont l’image miroir l’une de l’autre mais, à l’instar de nos mains, ne se superposent pas, on parle de chiralité et chaque composé est appelé l’énantiomère de l’autre. On pourrait penser que ces molécules existent et sont utilisées à parts égales dans la nature, mais, par exemple, les acides aminés sont tous des énantiomères gauches et les sucres des énantiomères droits. De nombreuses interrogations subsistent sur quand et comment la vie a fait ces choix au cours de l’évolution. Pour tenter d’y répondre, certaines théories ont prédit la possibilité d’un effet non linéaire dit hyperpositif, c’est-à-dire où la cohabitation à parts quasi égales de deux catalyseurs sélectionne davantage un énantiomère que s’il n’y avait qu’un seul catalyseur. Une équipe de l’Institut de physique et chimie des matériaux de Strasbourg (IPCMS, CNRS/Université de Strasbourg) a, pour la première fois, montré que ce cas de figure était effectivement expérimentalement observable.
Les chercheurs ont pour cela étudié une réaction de réduction d’aldéhydes, avec l’aide de catalyseurs à base de zinc. Elle n’a pas été choisie pour ses applications potentielles, mais en tant que bonne candidate pour prouver la possibilité d’une catalyse non linéaire hyperpositive. Dans ce système, le catalyseur est présent sous deux formes : une molécule simple, le monomère, et deux de ces monomères attachés, le dimère. Chacune favorise un énantiomère différent. Le monomère est un catalyseur plus actif que le dimère, pourtant composé de deux fois ce monomère, mais ces concurrents sont en équilibre l’un avec l’autre. Lorsque le catalyseur est presque racémique, c’est-à-dire si les proportions sont presque égales, l’équilibre favorise le monomère, qui est plus efficace que le dimère, ce qui provoque un effet hyperpositif. Les chercheurs vont continuer d’étudier le phénomène pour comprendre comment il se produit dans la nature.
Référence :
Y. Geiger, A. Maisse-François, T. Achard, S. Bellemin-Laponnaz. Hyperpositive nonlinear effects in asymmetric catalysis. Nat Catal (2020) 3, 422–426.